Fattori di rischio e diagnosi di tromboembolismo venoso (TEV). Validazione score TEVere. Studio osservazionale nei Reparti di Medicina Interna e nei Dipartimenti di Emergenza e Urgenza delle Regioni Lazio e Umbria.
Introduzione
La trombosi venosa profonda (TVP) e/o l’embolia polmonare (EP), cumulativamente indicate con il termine di tromboembolismo venoso (TEV), rappresentano la prima causa di morbosità e mortalità prevenibile tra i pazienti ospedalizzati e un problema rilevante dopo la dimissione ospedaliera.
La trombosi venosa profonda degli arti inferiori e l’embolia polmonare, per la loro frequenza e per il possibile esito infausto, sono condizioni che coinvolgono costantemente i Dipartimenti di Medicina ma s
pesso non sono tempestivamente sospettate e ciò determina la sottostima della loro reale incidenza, la diagnosi tardiva e conseguenze negative sulla morbilità e sulla mortalità (1).
Il TEV costituisce la terza causa di morte cardiovascolare dopo l’infarto e l’ictus; ogni anno in USA si verificano 60.000-200.000 decessi a seguito di embolia polmonare (2).
In Italia la stima è di 100 nuovi casi per anno/100.000 (3).
E’ caratteristica del TEV la mancanza di segni premonitori, fino all’80% delle EP decorre senza segni di esordio. Da qui nella maggior parte dei casi il sospetto clinico non viene posto a fronte di una elevata mortalità: il 10% dei pazienti muore nella prima ora dall’inizio dei sintomi.
I rilievi autoptici dimostrano l’alta prevalenza di TVP: 1 paziente su 100 ospedalizzati muore di EP (4,5).
In considerazione di quanto sopra, emerge l’opportunità che ogni ospedale si doti di specifiche linee guida di profilassi e di strumenti che ne verifichino la costante applicazione.
La patogenesi del TEV coinvolge la triade : stasi venosa, vasodilatazione degli arti inferiori e alterazioni della coagulazione. Alla patogenesi concorrono fattori genetici e fattori acquisiti.
La trombofilia ereditaria dovrebbe esser sospettata in pazienti con episodi ricorrenti di TVP, storia familiare, età inferiore ai 45 anni e comunque in assenza di apparenti fattori di rischio acquisiti. Le cause genetiche e acquisite spesso interagiscono e questo rende difficile decidere quali pazienti studiare per la trombofilia ereditaria.Tra i fattori genetici possiamo distinguere delle mutazioni più comuni quali quella del fattore V di Leiden , della protrombina o la mutazione in omozigosi del gene della reduttasi del metilentetraidrofolato; forme rare sono la carenza di antitrombina o di Proteina C o di Proteina S. Forme molto rare la disfibrinogenemia, omocistinuria (Homozygous homocystinuria). Esistono poi delle forme di probabile natura genetica: elevati livelli di fattore VIII, fattore IX, fattore XI o fibrinogeno. Va ricordato che soltanto una minoranza di pazienti affetti da tromboembolia venosa mostra predisposizione genetica e che alcuni di questi pazienti non svilupperanno mai una alterazione della coagulabilità del sangue clinicamente evidente
I fattori di rischio acquisiti sono rappresentati da interventi chirurgici, traumi, immobilizzazione protratta, lunghi viaggi, età avanzata, obesità, fumo di sigaretta , neoplasie, pregresso TEV, gravidanza e puerperio, contraccettivi orali o terapia di sostituzione ormonale nel periodo post- menopausale, resistenza alla proteina C attivata non legata ad alterazioni del gene del fattore V, positività per anticorpi antifosfolipidi, forme lievi-moderate di iperomocisteinemia (6).
Complessivamente i difetti di inibitori naturali della coagulazione (AT III, pC, pS) sono presenti in meno dell’1% della popolazione generale e in meno del 10% di pazienti non selezionati con TEV. In un terzo dei pazienti con TEV è diagnosticabile un difetto trombofilico; la determinazione dell’omocisteinrmia basale può permettere l’identificazione di una ulteriore quota di pazienti pari ad almeno il 10%, ottenendo una resa diagnostica globale superiore al 40% dei casi (7).
Se è sempre valida la distinzione tra cause genetiche e cause acquisite di trombofilia è però da sottolineare come le nuove acquisizioni sui polimorfismi genetici (fattore V Leiden, protrombina
G20210A) abbiano portato ad una ridefinizione della malattia tromboembolica venosa da modello unicausale (evento legato alla presenza di un unico fattore di rischio genetico) a modello multicausale (evento trombotico legato all’interazione tra difetti multigenici e situazioni a rischio),
Tale modello di interazione gene-gene e gene-ambiente è inoltre esemplificato dal rischio trombotico associato ad aumentati livelli di omocisteinemia, che a loro volta possono derivare dalla presenza di sistemi enzimatici difettivi per polimorfismi genetici soprattutto in particolari situazioni acquisite quali carenze vitaminiche (8,9,10).
TEV e MALATTIE MEDICHE
Negli ultimi anni accanto ai classici fattori di rischio legati agli interventi chirurgici, specie ortopedici, stanno assumendo un ruolo sempre maggiore le malattie internistiche, verosimilmente a ragione della elevata incidenza di comorbilità. Il rischio di TEV nel paziente medico è pari a quello chirurgico, ma la profilassi è largamente insufficiente.
Condizioni mediche riconosciute a rischio di TEV sono: scompenso cardiaco, affezioni respiratorie acute, immobilizzazione, malattia infiammatoria intestinale, sepsi, neuropatie acute (5). Deve inoltre essere sempre considerata la presenza di fattori di rischio predefiniti come età, neoplasia, obesità, pregresso TEV, terapia estro-progestinica, insufficienza venosa cronica, insufficienza respiratoria cronica.
Da qui emerge come il paziente internistico, spesso già di per sé a rischio di TEV per la condizione che ha determinato il ricovero, abbia un rischio cumulativo incrementato dalla concomitante presenza di fattori di rischio associati. Studi clinici su casistiche ampie come MEDENOX, ARTEMIS e PREVENT hanno dimostrato che questa categoria di pazienti presentano spesso una associazione di fattori di rischio e che la profilassi adeguata comporta una drastica riduzione degli eventi di TEV (11).
Alcuni dati che riportiamo di seguito aiutano a comprendere la dimensione del problema. Tra pazienti con esordio non ospedaliero di TEV, il 36,8 % era stato ospedalizzato nei tre mesi precedenti, la metà era stata ospedalizzata per ragioni mediche e solo la metà era stata sottoposta a chirurgia. La profilassi del TEV è stata largamente insufficiente: oltre il 40% dei pazienti non aveva ricevuto alcuna profilassi durante l’ospedalizzazione (profilassi 59,7%; 42,8% profilassi farmacologica, 16,9% solo meccanica). La breve durata dell’ospedalizzazione (4 giorni pazienti internistici,7,4 giorni pazienti chirurgici) non giustificava l’omissione della profilassi. Non è irragionevole supporre che una migliore profilassi ospedaliera sarebbe stata utile poiché i 2/3 dei casi di TEV si sono verificati nel primo mese, e il 41% nelle prime due settimane (12).
Possiamo concludere che tutti i pazienti ricoverati per una patologia medica acuta dovrebbero essere valutati per la profilassi antitrombotica.
RAZIONALE
Esistono numerose scale di valutazione validate per il riconoscimento dei fattori di rischio di TEV che sono però caratterizzate da rilevanti differenze; in particolare poi alcune scale considerano fattori di rischio che non vengono presi in esame da altre, ponendo di fatto il medico internista, anche se attento al problema TEV, davanti a una scelta talvolta complessa .
Sul NEJM del 2005 Kucher e e colleghi (13) propongono una scala in cui ciascun fattore di rischio viene pesato su una scala di punteggio numerico. Fattori di rischio maggiori sono cancro, pregresso TEV e ipercoagulabilità con un punteggio pari a 3. Fattore di rischio intermedio è la chirurgia maggiore cui è assegnato un punteggio pari a 2. Ai fattori di rischio minori (età’ avanzata, obesità, riposo a letto, terapia estroprogestinica in atto) viene assegnato un punteggio di 1. Si definisce a rischio tromboembolico il paziente con un punteggio complessivo uguale o maggiore a 4; cosi chi ha un fattore di rischio maggiore e almeno uno intermedio o minore rientra nella categoria di rischio .In assenza di fattori maggiori sono pazienti a rischio anche quelli che hanno almeno un fattore di rischio intermedio e due fattori di rischio minori . Per ipercoagulabilità si intende la positività di test di laboratorio inclusa la presenza di fattore V di Leiden, lupus anticoagulant e anticorpi anticardiolipina. Per chirurgia maggiore si intende un intervento chirurgico di durata uguale o superiore ai 60 minuti . Immobilizzazione a letto è inteso quella di tutti i casi non legati a patologia chirurgica . Età avanzata uguale o superiore ai 70 anni . Obesità si intende indice di massa corporea maggiore di 29 . Nella tabella n.1 sono riportati i criteri di rischio secondo Kucher e coll.
Esistono numerose altre scale di punteggio per la valutazione del rischio tromboembolico.
Tra le più più note e citate quella di Caprini (14) e quella di a Chopard (15) che rielabora scale già precedentemente pubblicate (16) e segue le raccomandazioni da parte dell’American College of Chest Physicians (ACCP) del 2004. La scala di Chopard è rivolta esclusivamente ai pazienti con patologia medica acuta (tabella 2). Il cut off per l’indicazione ad effettuare tromboprofilassi è stato individuato nel punteggio pari a 3.
TAB.1

TAB 2 Chopard P et al. J Thromb Haemost 2006;4:915-916
|
Item |
Punteggio |
|
Item |
Punteggio |
|
Insufficienza cardiaca |
2 |
Immobilizzazione |
1 |
|
|
Insufficienza respiratoria |
2 |
Viaggio recente (>6 ore) |
1 |
|
|
Ictus recente |
2 |
Età >60 anni |
1 |
|
|
Infarto miocardico recente |
2 |
Obesità (BMI >30 kg/m2) |
1 |
|
|
Malattia infettiva acuta |
2 |
Insufficienza venosa cronica |
1 |
|
|
Malattia reumatica acuta |
2 |
Gravidanza |
1 |
|
|
Neoplasia |
2 |
Terapia ormonale |
1 |
|
|
Sindrome mieloproliferativa |
2 |
Disidratazione |
1 |
|
|
Sindrome nefrotica |
2 |
|
|
|
|
Storia di TEV |
2 |
|
|
|
|
Stato di ipercoagulabilità |
2 |
|
|
L’American College of Chest Physicians nel 2008 (ACCP08) (1) confermava i fattori di rischio già riconosciuti nella precedente edizione del 2004 (Tab 3) e identificava delle raccomandazioni 1A per la stratificazione del rischio trombotico in base a criteri clinici (presenza di almeno un fattore di rischio tra insufficienza cardiaca, insufficienza respiratoria e allettamento + presenza di almeno un fattore di rischio compreso tra pregresso TEV, neoplasia in fase attiva, sepsi, ictus recente, malattia infiammatoria intestinale).
Tuttavia sempre l’ACCP 08, ribadendo come i diversi score a disposizione non erano tra loro sovrapponibili e che di conseguenza la stratificazione del rischio era spesso non univoca, suggeriva che poteva essere parimenti attendibile e sicuramente più maneggevole una suddivisione dei pazienti in categorie di rischio per TEV sulla base del solo criterio della immobilizzazione (Tab 4).
TAB 3
FATTORI DI RISCHIO PER TEV
- Chirurgia
- Trauma (maggiore o degli arti inferiori)
- Immobilizzazione, paralisi arti inferiori
- Cancro (attivo o occulto)
- Terapia antineoplastica (ormonale, chemioterapia, inibitori dell’angiogenesi, radioterapia)
- Compressione venosa (tumore, ematoma, anormalità arteriosa)
- Pregressa TV
- Età avanzata
- Gravidanza e post partum
- Terapie estrogeniche contraccettive o ormonali
- Modulatori dei recettori selettivi degli estrogeni
- Agenti che stimolano l’emopoiesi
- Malattie mediche acute
- Malattia infiammatoria dell’intestino
- Sindrome nefrosica
- Disordini mileoproliferativi
- Emoglobinuria parossistica notturna
- Obesità
- Cateterizzazione venosa centrale
- Trombofilia ereditaria o acquisita
|
BASSO RISCHIO Pazienti medici mobilizzati |
TVP <10 |
EP SINTOMATICA < 1 |
STRATEGIE PREVENTIVE Nessuna misura specifica, mobilizzazione precoce |
|
RISCHIO MODERATO |
10-40% |
1-4 |
EBPM, ENF ogni 8 ore, fondaparinux |
TAB 4: tabella adattata per pazienti medici in assenza di profilassi e strategie suggerite.
Nel tentativo di poter colmare il “gap” tra profilassi del TEV in chirurgia e in medicina, negli ultimi anni abbiamo assistito ad una serie di studi condotti rivolti a ricercare uno score se non ideale quantomeno in grado di dirimere una parte delle criticità che, come visto, sono stati rivolti a quelli storicamente in uso (Kucher, Chopard, ACCP08).
Tra i più significativi il Padua score (Tab 5) (17) che, per la sua praticità ed attendibilità, ha riscosso da più parti un gran consenso tanto che attualmente, nelle recentissime linee guida ACCP’12 (18), viene indicato quale lo score di riferimento nella predizione del rischio TEV nel paziente internistico.
TAB 5
|
Score di Padova |
||
|
FATTORE DI RISCHIO |
Punteggio |
|
|
|
|
|
|
Cancro attivo * |
3 |
|
|
TEV precedente ** |
3 |
|
|
Ipomobilità *** |
3 |
|
|
trombofilia nota**** |
3 |
|
|
|
|
|
|
Trauma e/o chirurgia recente (< 1 mese) |
2 |
|
|
|
|
|
|
Età > 70 anni |
1 |
|
|
Insuff. cardiaca e/o respiratoria |
1 |
|
|
IMA o Stroke |
1 |
|
|
Infez. acuta e/o Pat. reumatica |
1 |
|
|
Obesità (BMI > 30) |
1 |
|
|
Trattamento ormonale in atto |
1 |
|
|
|
|
|
|
SCORE TOTALE |
||
|
< 4 BASSO RISCHIO DI TEV |
≥ 4ALTO RISCHIO DI TEV |
|
* metastasi locali o distanti e/o CT o RT effettuata negli ultimi 6 mesi
** escluse le trombosi venose superficiali
*** allettamento o possibilità di accedere solo al bagno (sia per le limitazioni dovute alla patologia
che per ordine medico) per almeno 3 giorni
**** difetti di AT, Proteina C o S, FV Leiden, Variante protrombinica 20210, LAC/APA
Proprio alla luce delle ricordate difficoltà incontrate nel condividere lo score ideale per identificare il paziente a rischio di TEV in area medica, l’AMEC ha promosso due studi osservazionali, condotti su oltre 22 unità operative di medicina interna e d’urgenza sia di Roma che di tutta la Regione Lazio. Il primo studio aveva come fine quello di valutare la percezione del rischio di TEV mentre il secondo era rivolto alla individuazione ed alla valutazione, in caso di TEV, dei principali fattori di rischio nel tentativo di proporre uno score da poter essere condiviso nella nostra area geografica al fine di una corretta stratificazione del rischio trombotico.
La modalità con cui il primo studio, quello sulla percezione del rischio di TEV, era stato definito ci ha permesso inoltre di valutare nella popolazione esaminata la distribuzione del rischio in base agli score considerati, confermando come gli score del rischio di TEV attualmente in uso non forniscano una stima omogenea del rischio. Ad esempio, utilizzando la scala di Chopard la percentuale di pazienti a rischio è di gran lunga superiore rispetto a quella calcolata a rischio utilizzando la scala di Kucher, pur nella stessa popolazione di pazienti.
In tal modo abbiamo dimostrato come, pur se in aderenza con gli score, non si riesce ad ottemperare ad una univoca prevenzione del rischio trombotico; infatti nella stessa popolazione di pazienti non vi è concordanza tra le stratificazioni del rischio evidenziate con i vari score proposti.
Nel secondo studio invece abbiamo preso in esame solo i pazienti con nuovi episodi di TEV e abbiamo correlato l’evento TEV con la presenza o meno dei principali fattori di rischio sia considerati singolarmente che quando compresi nei principali score, dai classici Chopard, Kucher e ACCP08 a quelli più recenti, in particolare il Padua score, rivisitandoli anche sotto il profilo della sensibilità e della specificità.
Abbiamo poi rivalutato i fattori di rischio evidenziati nella nostra popolazione, suddividendoli in a basso ed elevato rischio, con il fine di ricavare dai dati provenienti dal nostro campionamento un nuovo score.
Siamo così riusciti ad individuare due score, TEVere1 e TEVere2, la cui specificità e sensibilità è stata raffrontata con quelle precedentemente descritte e relative agli score Kucher, Chopard, ACCP08, Padua score. Nella nostra popolazione la sensibilità e la specificità di ambedue gli score TEVere sono risultate nel complesso superiori rispetto a quelle ottenute con gli altri score sopra indicati.
Lo scopo del presente studio è quello di confermare la validità del nostro score a seguito del campionamento di nuovi casi di TEV per avere una maggiore casistica su cui confrontarsi. A tal fine, questo studio viene proposto, oltre che alle unità operative di medicina interna e d’urgenza della regione Lazio, anche a quelle della regione Umbria, anch’essa attraversata dal fiume Tevere.
METODOLOGIA
a) Progetto dello studio “TEVere”. Seconda parte.
Fattori di rischio e diagnosi di tromboembolismo venoso (TEV). Validazione score TEVere. Studio osservazionale nei Reparti di Medicina Interna e nei Dipartimenti di Emergenza e Urgenza delle Regioni Lazio e Umbria.
b) Obiettivo dello studio:
- valutare la correlazione tra fattori di rischio ed evento TEV
- confrontare il ruolo dei singoli fattori di rischio sia da soli che in associazione con quanto già emerso nel corso dello studio TEVere prima parte
- validare o ridefinire, alla luce dei risultati ottenuti, lo score TEVere già individuato nella prima parte dello studio
c) Reclutamento
Si tratta di uno studio caso controllo osservazionale con rapporto 1 a 2. Per ogni caso di TEV saranno registrati i dati anche dei due pazienti successivi di pari sesso e nella stessa classe di età
ma che non hanno l’evento. Le classi di età considerate sono: da 18 a 50 anni, 50-55, 55-60, 60-65,65-70,70-75, 75-80, >80 anni.
d) Raccolta dati:
La raccolta dei dati avrà la durata minima di 60 giorni consecutivi e massima di 90 giorni, periodo prevedibile per al’arruolamento di almeno 10 pazienti con nuova diagnosi di evento TEV. L’obiettivo è quello di raggiungere un campione di 200-250 pazienti (le unità operative partecipanti dovrebbero essere circa 30).
Criteri di inclusione:
- tutti i pazienti ricoverati con diagnosi di TEV in Unità di Medicina Interna e nei Dipartimenti di Emergenza e Urgenza della Regione Lazio ed Umbria
- tutti i pazienti con diagnosi di TEV in Pronto Soccorso a cui fa seguito la dimissione, il trasferimento presso altro ospedale non partecipante allo studio o il ricovero in un reparto non di medicina interna o d’urgenza.
Criteri di esclusione:
Età < 18 anni
Cartella clinica non sufficiente per l’adeguato inserimento dei dati
Durata complessiva dello studio: 20-24 settimane
Lo studio sarà suddiviso in 3 fasi per una durata temporale complessiva di 20-24 settimane:
La prima fase, della durata variabile da 8 a 12 settimane, prevede la raccolta dei dati in un arco di tempo compreso tra 60 e 90 giorni, con inizio concordato tra Centro Coordinatore e singole Unità Operative. L’inserimento dei dati avverrà in una apposita scheda raccolta dati predisposta dal centro coordinatore, da compilare in ogni sua parte
La seconda fase, di 4 settimane, prevede l’invio via mail o via fax della scheda raccolta dati al centro coordinatore che provvederà al controllo e quindi all’inserimento dei dati in un modulo ad hoc predisposto dal centro coordinatore
La terza fase, di 8 settimane, è volta alla analisi, alla elaborazione dei dati ed alle considerazioni conclusive.
e) Metodi:
Compilazione, da parte dei medici ricercatori delle Unità Operative partecipanti allo studio, della scheda raccolta dati in ogni paziente con diagnosi di TEV.
I medici ricercatori compileranno successivamente la stessa scheda nei due pazienti visitati in maniera consecutiva a quelli con TEV e che non hanno avuto l’evento, al fine di ottemperare al duplice caso controllo. Il campionamento è rivolto a tutti i pazienti con nuova diagnosi di TEV anche a quelli che non avranno bisogno del successivo ricovero ma saranno dimessi da Pronto Soccorso con una terapia domiciliare.
Elaborazione statistica:
A seguito della codifica dei dati e del loro inserimento su supporto elettronico, saranno calcolate le statistiche di base (medie e frequenze) per la descrizione del campione osservato.
Organizzazione dello studio
Lo studio, proposto dall’AMEC Lazio, prevede un Comitato Tecnico Scientifico a cui è affidata la fase di organizzazione e il corretto svolgimento dello studio stesso sino alla elaborazione dei dati ed alla stesura delle considerazioni conclusive.
Responsabile dello studio: dott. Giovanni Maria Vincentelli, Coordinatore AMEC Lazio
I componenti del Comitato Tecnico Scientifico sono:
Prof. Enrico Bologna, Prof. Claudio Di Veroli, Dr. Manuel Monti, Dr. Maria Rosaria Pirro, Dr. Giovanni Maria Vincentelli, referenti AMEC
Prof. Filippo Alegiani, referente per i Reparti di Medicina Interna Regione Lazio
Prof. Massimo De Simone, referente per i Reparti di Medicina di Urgenza Regione Lazio
Prof. Francesco Borgognoni, referente per i Reparti di Medicina Interna e di Urgenza Regione Umbria
Centro Coordinatore: Ospedale Fatebenefratelli - Isola Tiberina Roma. Reparto Breve Osservazione - Medicina d’Urgenza
Centri partecipanti: Reparti di Medicina Interna e d’Urgenza della Regione Lazio e Umbria
Prima dell’inizio dello studio sarà organizzato un incontro tra i Centri partecipanti durante il quale il responsabile e coordinatore del progetto illustrerà il protocollo, la metodologia e le modalità di compilazione della scheda raccolta dati.
Bibliografia:
- ACCCP , Chest, June 2008;133 (Suppl :67S-968S).
- Tapson , Current Therapy 2005
- Giuntini C et al. Pulmonary Embolism: Epidemiology, Pathophysiology, Diagnosis, and Management . Chest 1995;107:3S-9S
- Gossage, Current Therapy 2003
- Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126: 338S –400S.
- NEJM, vol. 344, no. 16 April 19, 2001, Genetic susceptibility to venous thrombosis.
- Giornale Italiano di Nefrologia / Anno 26 S-46, 2009 / pp. S14-S19 Le trombofilie congenite. De Stefano Istituto di Ematologia, Università Cattolica, Roma
- Rosendal FR. Venous thrombosis: a multicausal disease. Lancet 1999; 353: 1167-73.
- Cattaneo M. Hyperhomocysteinemia, atherosclerosis and thrombosis. Thromb Haemost 1999;81: 165-76.
- De Stefano V, Casorelli I, Rossi E, Zappacosta B, Leone G. Interaction between hyperhomocysteinemia and inherited thrombophilic factors in venous thromboembolism. Semin Thromb Hemost 2000; 26: 305-11.
- .Mismetti et al . Prevention of venous thromboembolism in internal medicine with unfractionated or low-molecular-weight heparins: a meta-analysis of randomised clinical trials. Thromb Haemost 2000; 83: 14-19
- Spencer FA et al. Venous Thromboembolism in the Outpatient Setting. Arch Intern Med 2007;167(14):1471-1475
- Nils Kucher, M.D., Sophia Koo, M.D. et al.Electronic Alerts to Prevent Venous Thromboembolism among Hospitalized Patient NEJM 352;10
- Caprini JA, Hyers TM. Compliance with antithrombotic guidelines. Manag Care 2006 Sep;15(9)
- Chopard . Identifyng acutely ill medical patients requiring thromboprophylaxis; J thromb Haemost 2006 Apr ; 4 (4): 915-6
- Lutz L, Haas S, Hach –Wunderle V, Betzl G, Jamartz H. Venous thromboembolism in internal medicine : risk assessment and pharmaceutical prophylaxis . Md Welt 2002; 53 :231-4.
- 17Barbar S t al . J Thromb Haemost . 2010 ; 8 ( 11 ): 2450 – 2457 .
- 18 ACCCP , Chest, June 2012;133 (Suppl :67S-968S).
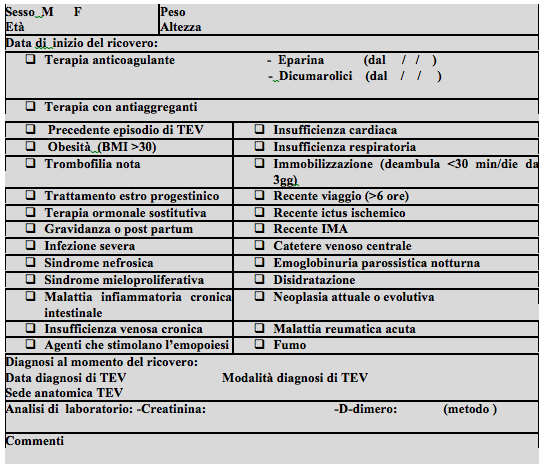
SCHEDA RACCOLTA DATI