Una nuova prospettiva nel trattamento del diabete mellito
Enrico Bologna
Specialista in Medicina Interna, Gastroenterologia e Patologia generale.
Già Primario Ospedale Fatebenefratelli, Isola Tiberina, Roma.
Libero docente in Patologia Medica, Università di Roma “Sapienza”.
Nel 2000 ricercatori dell’Università di Kyoto hanno isolato in embrioni di topo il DNA che codifica per un Fattore di crescita dei fibroblasti (Fibroblast Growth Factor, FGF), prodotto dal fegato e costituito da 209 aminoacidi, che fu denominato FGF21.
I FGF sono fattori umorali proteici responsabili di diverse funzioni biologiche, per lo più relative alla regolazione locale della mitosi e della differenziazione cellulare, della angiogenesi e della riparazione di ferite.
Fra i 22 FGF finora isolati nell’uomo e in animali, alcuni agiscono come fattori sistemici, in particolare: FGF19, espresso dall’epitelio intestinale, interviene nella sintesi degli acidi biliari e nell’accumulo lipidico negli epatociti; FGF23, secreto principalmente dagli osteoblasti, inibisce il riassorbimento renale dei fosfati e la sintesi di Vit. D.
Le ricerche condotte su FGF21 dimostrarono che esso è in grado di aumentare la sensibilità all’insulina e di svolgere effetti favorevoli sul metabolismo glicidico e lipidico; inoltre, che a differenza da altri FGF è privo di attività mitogena. Questo polipeptide, quindi, deve essere annoverato fra i nuovi farmaci antidiabetici sperimentali (Tab. 1).
Il rilievo, effettuato dagli stessi autori, che un n FGF-21 per il 75% analogo a quello murino è presente anche nell’uomo ha dato origine ad un grande numero di ricerche sperimentali. Queste hanno dimostrato che FGF21 è un potente attivatore della captazione epatocitaria di glucosio attraverso l’aumentata espressione del trasportatore GLUT-1 e che la somministrazione a roditori resi diabetici determina una rilevante e persistente riduzione dell’insulinemia, della glicemia e dei trigliceridi senza svolgere azione mitogena e senza indurre ipoglicemie né aumenti di peso.
Negli stessi animali FGF21 riduce l’espressione di Insulin-like Growth Factor-1 ed aumenta la resistenza al GH; inoltre protegge la funzione e la sopravvivenza delle cellule pancreatiche β.
Queste osservazioni hanno trovato conferma in studi su primati: in scimmie rese diabetiche la somministrazione di FGF21 determina netto aumento di HDL-C e riduzione altamente significativa di glucosio, fruttosamina, trigliceridi, insulina e glucagone nel plasma prelevato a digiuno; provoca inoltre riduzione del peso corporeo, mentre non dà luogo ad episodi di ipoglicemia /Ta. 3, 4, 5).
I primi studi condotti nell’uomo hanno dimostrato che la concentrazione plasmatica di FGF21 è significativamente aumentata nei soggetti con diabete mellito tipo 2 e con sindrome metabolica, nei quali è correlata positivamente con peso corporeo, circonferenza addominale, trigliceridemia e insulinoresistenza (HOMA IR) e negativamente con HDL-C. Questo aumento di FGF21 viene interpretato come risposta compensatoria o come manifestazione di aumentata resistenza.
In soggetti con anoressia nervosa la concentrazione plasmatica di FGF21 è significativamente ridotta rispetto al gruppo di controllo; in entrambi i gruppi è correlata positivamente con la concentrazione di Leptina e di Insulina e con BMI, negativamente con Adiponectina.
Questa osservazione fa ipotizzare il coinvolgimento di FGF21 nell’anoressia nervosa come risposta di adattamento.
Un altro aspetto di grande interesse è rappresentato dal rapporto tra FGF21 e PPAR. E’ stato infatti osservato che gli agonisti di PPARα come i fibrati o il composto sperimentaleWy 14643 e gli agonisti di PPARγ tiazolidinedioni [Tab. 2] stimolano la produzione di FGF21 negli adipociti e rispettivamente negli epatociti. In colture di epatociti umani questi stessi agonisti inducono aumento di FGF21 mRNA .
In base alle osservazioni fino ad oggi riportate, quindi, sembra sia possibile attribuire a FGF21 il ruolo di un legame finora sconosciuto tra attività dei PPAR e componenti della sindrome metabolica e in particolare diabete, obesità, dislipidemia.
Se verrà confermato che FGF21 è un (o il?) mediatore degli effetti desiderati dei PPAR sul metabolismo l’interesse per questo fattore aumenterà ulteriormente sul piano concettuale e su quello pratico. Ciò in considerazione sia del ruolo centrale dei PPAR nella patogenesi di molte componenti della sindrome metabolica e in particolare del metabolismoglicidico, sia degli effetti avversi rilevati nelle sperimentazioni condotte con vari agonisti dei PPAR come Muraglitazar e Tesaglitazar, cioè insufficienza cardiaca, insufficienza renale, rabdomiolisi ed aumento del peso corporeo o degli effetti avversi temuti, in particolare la carcinogenesi.
Negli USA questi timori hanno indotto
Considerata l’attuale disponibilità di FGF21 murino ricombinante, vi sono le condizioni per l’attuazione di sperimentazioni pilota nell’uomo.
Le possibilità aperte dalla terapia incretinica (analoghi di GLP-1 e inibitori di DPP-4) e ancora di più le prospettive di un possibile uso di FGF-21 rivestono un interesse del tutto particolare per la capacità che queste sostanze hanno di correggere, insieme con il metabolismo glicidico, molte delle componenti patogenetiche che concorrono a peggiorare il rischio cardiovascolare dei pazienti diabetici: ciò a differenza dagli altri ipoglicemizzanti finora in uso, che sotto questo profilo sono neutri o dannosi.
| FARMACI ANTIDIABETICI | Disponibili | Sperimentali | ||
| Insulinosensibilizzanti | Biguanidi | Metformina | ||
| Secretagoghi | Sulfoniluree | (1° gen.) |
Clorpropamide,Gliclazide, Tolbutamide, Tolazamide |
|
| (2° gen.) |
Glibenclamide, Glipizide, Gliquidone |
|||
| (3° gen.) | Glimepiride | |||
| Meglitinidi | Repaglinide, Nateglinide | Mitiglinide | ||
| Inibitori α-glucosidasi | Acarbosio | Miglitolo, Voglibosio | ||
| Analoghi di Amilina | (Pramlintide) | |||
| Analoghi di Insulina | Azione rapida | I. lispro, I. aspart, (I. glulisina) | ||
| Azione protratta | I. glargine, I. detemir | |||
| Insulina inalabile | [Exubera®] | |||
| Agonisti PPAR α | WY14643 | |||
| “ “ γ | Tiazolidinedioni | Pioglitazone, Rosiglitazone | Aleglitazar | |
| Incretinici | GLP-1 analoghi | Exenatide, Liraglutide | Albiglutide, Taspoglitide | |
| DPP4-inibitori | Sitagliptin, Vildagliptin |
Alogliptin, Linagliptin, Saxagliptin |
||
|
Fattori di crescita dei fibroblasti (FGF) |
FGF-21 ricombinante | |||
| Trasportatori di glucosio | SGLT-1 |
Depaglifozin, Remoglifozin, Serglifozin |
||
|
Tab. 1 (Modif. da Nathan DM, Buse JB, |
||||

Tab. 2
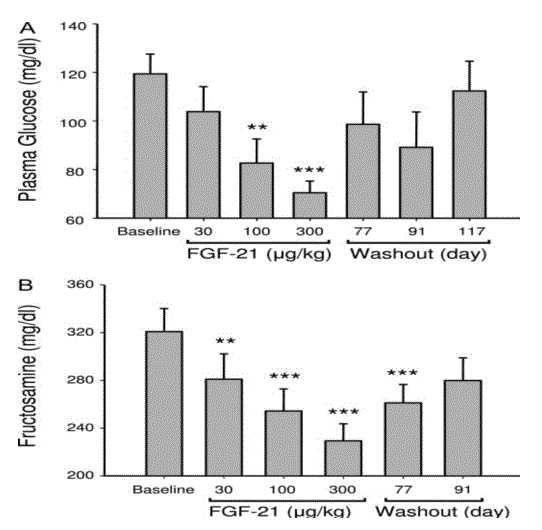
Tab.3 (da Kharitonenkov A, Wroblewski VJ, Koester A & al: Endocrinology 2007:148,77)
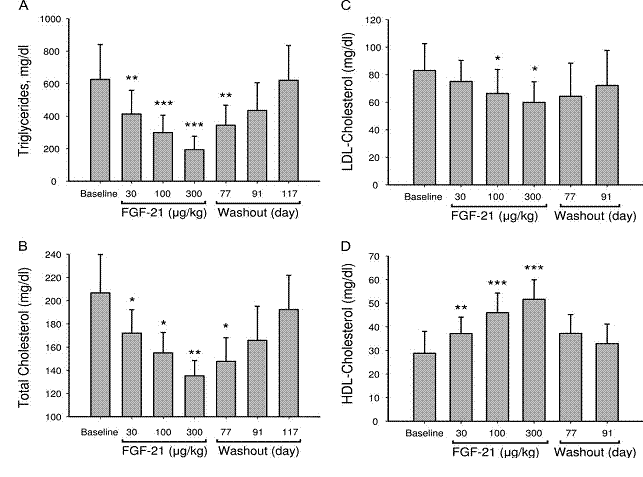
Tab. 4 (da Kharitonenkov A, Wroblewski VJ, Koester A & al: Endocrinology 2007:148,77)
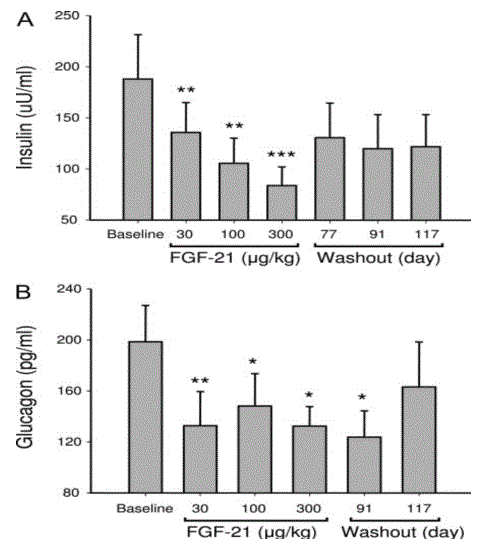
Tab. 5 (da Kharitonenkov A, Wroblewski VJ, Koester A & al:Endocrinology 2007:148,77)
BIBLIOGRAFIA
-
Batman MK, Pissios P, Kennedy AR al: Hepatic fibroblast growth factor 21 is regulated by PPARalpha and is a key mediator for hepatica lipid metabolism in ketotic states.
Cell Metab 2007:5,426 -
Bays H, McElhattan J, Bryzinski BS: A double blind, randomised trial of tesaglitazar versus pioglitazone in patients with type 2 diabetes mellitus.
Diabetes Vasc Dis Res 2007:4,18 - Center for Drug Evaluation and Research, FDA, febbraio 2007
-
Chen WW, Li L, Yang GY & al: Circulating FGF-21levels in normal subjects and in newly diagnose patients with type 2 diabetes mellitus.
Exp Clin Endocrinol Diabetes 2008:116,65 -
Dostálová I, Kaválková P, Haluziková D & al: Plasma concentration of fibroblast growth factors 19 and 21 in patients with anoressia nervosa.
J Clin Endocrinol Metab 3008:93,3627 -
Fagerberg B, Shuster H, Birkevedt GS & al: Improvement of postprandial lipid handling and glucose tolerance in a non-diabetic population by the dual PPARalpha/gamma agonist, Tesaglitazar.
Diabetes Vasc Dis Res 2007:4,174 -
Fukumoto S: Actions and mode of actions of FGF19 subfamily members
Endocr J 2008:55,23 -
Herman GA, Stevens C, Van Dyck K & al<:Pharmacokinetics and pharmacodynamics of sitagliptin, an inhibitor of dipeptidyl peptidase IV, in healthy subjects: results from two randomized, double-blind, placebo-controlled studies with single oral doses.
Clin Pharmacol Ther 2005:78,675 -
Inagaki T, Lin VY, Goetz R & al: Inhibition of growth hormone signalling tha fasting- induced hormone FGF21.
Cell Metab 2008:8,77 -
Kharitonenkov A, Shiyanova TL, Koester A & al: FGF-21 as a novel metabolic regulator.
J Clin Invest 2005:115,1627 -
Kharitonenkov A, Wroblewski VJ, Koester A & al: The metabolic state of diabetic monkeys is regulated by fibroblast
growth factor-21.
Endocrinology 2007:148,77 -
Kharitonenkov A, Shanafeldìt AB : Fibroblast factor-21 as a therapeutic agent for metabolic diseases-
Biodrugs 2008:22,37 -
Lautar SL, Rojas C, Slusher BS & al: DPP IV inhibitor blocks mescaline-induced scratching and amphetamine-induced hyperactivity in mice.
Brain Res 2005:1048,177 -
Moyers JS, Shiyanova TL, Mehrbod F & al: Molecular determinants og FGF-21 activity-synergy and cross-talk with PPARgamma signalling.
J Cell Physiol 2007:210,1 -
Muise ES, Azzolina B, Kuo DW: Adipose fibroblast factor 21 is up-regulated by peroxisome proliferators-activated receptor gamma and altered metabolic states.
Mol Pharmacol 2008:74,403 -
Nishimura T, Nakatake Y, Konishi M, Itoh N: Identification of a novel FGF, FGF 21, preferentially expressed by the liver.
Biochim Biophys Acta 2000:1492,203 -
Oishi K, Uchida D, Ispida N: Circadian expression of FGF21 is induced by PPARalpha activation in the mouse liver.
FEBS Lett 2008:Oct 7 (Epub ahead of print) -
Ratner RE, Parikh S, Tou C: Efficacy, safety and tolerability of Tesaglitazar when added to the therapeutic regimen of poorly controlled insulin-treated patients with type 2 diabetes.
Diabetes Vasc Dis Res 2007:4,214. -
Reitman ML: FGF21: a missing link in the biology of fasting.
Cell Metab 2007:5,405 -
Tonstad S, Retterstø K, Ose L & al: The dual peroxisome proliferator-activated receptor alpha/gamma agonist Tesaglitazar further improves the lipid profile in dyslipidemic subjects treated with atorvastatin.
Metabolism 2007:56,1285 -
Wang H, Oiang L, Farmer SR: Identification of a domain within peroxisome proliferators-activated receptor regulating expression ofv a group of genes containing fibroblast growth factor 21 that are selectively repressed by SIRT1 in adipocites.
Mol Cell Biol 2008:28,188 -
Wente W, Efanov AM, Brenner M & al: Fibroblast growth factor-21 improves pancreatic β-cell function and survival by activation of extracellular signal-regulated kinase ½ and Akt signalling patways.
Diabetes 2006:55,470 -
Wild S, Roglic G, Green A & al: Global prevalence of diabetes: estimates for the year 2000 and projections for 2030.
Diabetes Care 2004:27,1047 -
Zhang X, Yeung DCY, Karpisek M & al: Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans.
Diabetes 2008:57,1246 -
Zu J, Lloyd DJ, Hale C & al: FGF21 reverses hepatic steatosis, increases energy expenditure and improves insulin sensitivity in diet-induced obese mice.
Diabetes 2008: Oct 7 (Epub ahead of print)
