Fisiologia dell’Invecchiamento
Attività protettive dell’olio extravergine di oliva
Publio Viola
Specialista in Gastroenterologia, Medicina tropicale e Scienza dell’alimentazione
Primario Medico Emerito - Ospedale San Giovanni, Roma
Libero docente in Medicina Sociale - Università di Roma “Sapienza”
Presidente Sezione Medico Nutrizionale dell’Accademia dell’Olivo e dell’Olio.
INTRODUZIONE
L’invecchiamento è la progressiva sequenza di modificazioni biologiche che conducono l’organismo verso un lento decadimento che si conclude con la cessazione della vita. Tale evoluzione si verifica entro un tempo determinato per ciascuna specie, anche se esiste una variabilità tra individuo e individuo legata a numerosi fattori interni ed esterni. Quanto alla razza umana, circa 300.000 anni fa avrebbe cominciato a differenziarsi dai primati assumendo l’aspetto somatico attuale, ma anche migliorando in maniera sensibile la durata massima della vita che, circa 100.000 anni fa, si è stabilizzata intorno ai 100 anni, con rarissimi casi che hanno superato i 110. Questo miglioramento fu forse dovuto ad una perdita di efficienza di alcuni ‘geni dell’invecchiamento’ o, più probabilmente, all’acquisizione di geni opposti ‘anti invecchiamento’. Una notevole importanza avrebbe comunque avuto lo sviluppo della massa cerebrale che è proceduto di pari passo con lo sviluppo dell’intelligenza e con la durata della vita. Tre milioni di anni fa infatti un ominide aveva la prospettiva di vivere al massimo 50 anni e le sue capacità intellettive lo distinguevano appena dagli altri primati superiori (1). E’ però necessario precisare che la durata della vita massima di un gruppo biologico non va confusa con la durata della vita media ed infatti oggi, mentre noi osserviamo un miglioramento notevole della durata della vita media, la durata della vita massima è rimasta praticamente invariata rispetto a quella di 100.000 anni fa e non si conoscono reali possibilità di aumentarne i suoi limiti. Il progresso delle conoscenze scientifiche ci ha consentito infatti di ridurre notevolmente la mortalità nel- l’infanzia, nell’età matura e nella stessa senescenza, migliorando così la speranza della vita media, ma non ci ha consentito di spostare quell’orologio biologico la cui suoneria è inscritta nel patrimonio biologico di ciascuna specie e non sembra (almeno fino ad oggi) che possa essere modificata.
Nel corso della storia noi abbiamo assistito comunque ad un lento, ma progressivo aumento della durata della vita media, che è passata dai 22 anni dei tempi dell’antica Roma ai 47 dell’inizio del 1900, un progresso che ha avuto un ulteriore balzo in avanti nel ventesimo secolo per arrivare a 77 anni, determinando in soli 100 anni un miglioramento superiore a quanto era avvenuto in due millenni e, secondo le proiezioni dell’ONU, questo miglioramento sarà ulteriormente consolidato, in particolare per l’Italia che nel 2050 potrebbe rappresentare il primato mondiale di longevità.
Il prolungamento della durata della vita media è certamente dovuto miglioramento dello stile di vita ed ai notevoli progressi nel campo della medicina, ma non è escluso anche ad un migliore modo di alimentarsi che ha con- dotto a più favorevoli condizioni delle attività biochimiche dell’organismo. L’alimentazione infatti svolge un ruolo fondamentale nella vita dell’uomo fin dalla sua nascita, sia per il suo sviluppo che per la sua evoluzione.
Definizione di anziano
Onde stabilire i suggerimenti per una dieta corretta per la prevenzione dei fenomeni di invecchiamento appare necessario definire che cosa si intende per ‘anziano’, un individuo cioè avanti negli anni, ma ancora valido, oppure un individuo incapace di badare a se stesso (fisicamente e psicologicamente). Nel primo caso è più corretto parlare di ‘senescenza’, cioè di un periodo nel quale comi cia a diminuire la resistenza alle fatiche fisiche ed intellettuali, mentre compaiono ritardi nella memoria recente, diminuzione della attività sessuale ecc, ma si è ancora in grado di ragionare, di lavorare, di muoversi autonomamente e di produrre. Nel secondo caso, appare più esatto parlare di ‘vecchiaia’, o forse meglio di ‘vecchiaia conclamata’, una fase nella quale si verifica una evidente perdita della funzionalità degli organi, con turbe della memoria e del ragionamento, fenomeni che vanno gradualmente ingravescendo e rendono l’individuo non più autonomo, conducendolo lentamente verso la decadenza completa.
Senescenza
La senescenza è un periodo nel quale si verifica in maniera lenta, ma progressiva, una serie di modificazioni biologiche che riducono gradualmente l’efficienza fisico- psichica dell’organismo. Tale evoluzione può variare per fattori genetici, ma anche per fattori comportamentali tra i quali un ruolo importante viene giocato dall’ambiente sociale e dall’alimentazione che, se corretti, possono ritardarne l’evoluzione mentre, al contrario, se non corretti, la possono accelerare. Riesce difficile riconoscere l’inizio della senescenza e stabilire quando comincia il processo fisiologico del decadimento fisico e mentale, in quanto spesso tale processo si manifesta in maniera poco evidente e non tutti i disturbi appaiono in epoca contemporanea. Non è possibile perciò stabilire un momento preciso, ma sicuramente tra il quinto ed il sesto decennio della vita si manifestano i primi segni del decadimento, anche se talora questi segni si presentano in forma lieve e vengono perciò ignorati e/o sottovalutati sia dal soggetto, che da chi lo circonda.
L’evoluzione della vita nel tempo è comunque un evento ineluttabile in quanto la natura si preoccupa della prosecuzione e del mantenimento della specie, ma non del singolo individuo. Il nostro corpo e la nostra mente subiscono infatti una trasformazione continua che corrisponde, in una prima fase, ad un arco ascendente nel quale si vive in maniera ottimale (per circa quarant’anni) ed, in una seconda fase, ad un arco discendente nel quale si riesce a vivere in maniera sempre meno ottimale (per altri quaranta).
Vecchiaia
La vecchiaia, o, come si è detto, la ‘vecchiaia conclamata’, è una situazione nella quale la capacità di badare a se stessi è ormai decisamente compromessa, mentre compaiono (o si aggravano) i segni dei deficit funzionali degli organi e degli apparati, qualora non si manifestino apertamente alcune malattie che compromettono l’organismo fino al possibile rischio di morte. L’individuo diventa gradualmente incapace di svolgere le proprie attività diventando sempre più dipendente da altri, ed in questa fase l’alimentazione è molto spesso controllata più da coloro che assistono il paziente che non dal paziente stesso.
FISIOLOGIA DELLA SENESCENZA
Esiste purtroppo un limite alla nostra speranza di vita, ma se questo è certo, non è altrettanto chiaro perché un sistema pluricellulare così perfetto e teoricamente programmato per replicarsi in maniera illimitata, cominci ad un certo punto a declinare. Numerose teorie hanno cercato di spiegare l’evoluzione della vita e la fisiologia del processo dell’invecchiamento. Tra queste ricordiamo:
Queste alterazioni determinano un progressivo decadimento dell’attività cellulare.
Gli studi attuali stanno portando sempre maggiori elementi a favore della teoria dei radicali liberi, che in parte si integra, completandole, con le precedenti. Come abbiamo visto infatti, secondo la teoria degli errori, ogni cellula possiede un’informazione nella quale è racchiuso il programma del codice genetico che ne organizza le attività e la replicazione in maniera teoricamente illimitata. Questa informazione può però subire nel tempo degli ‘inceppamenti’o ‘errori’ che ne alterano il programma. Il problema consiste pertanto nel cercare di individuare i fattori causali degli errori e, tra questi fattori, un ruolo preminente viene giocato dai ROS. Nella stessa maniera i ROS possono influire negativamente sul patrimonio immunitario alterando le sue capacità e le sue finalità.
- Teoria dei cloni Secondo questa teoria, formulata da Hayflik, per ogni specie esiste una durata della vita geneticamente definita. L’Autore, studiando la replicazione delle cellule diploidi, ha documentato che esiste un limite invalicabile al di là del quale le cellule non possono più replicarsi (2).
- Teoria immunologica Vede nel progressivo consumo del patrimonio immunitario (utilizzato nella varie contingenze della vita) l’incapacità di difendersi dalle aggressioni esterne ed interne che tendono a diminuire l’efficienza dell’organismo, che non riesce più a riparare le ‘rotture’ del DNA. Inoltre, il sistema immunitario perde la capacità di distinguere le molecole normali da quelle alterate, così che le prime possono essere vittime di reazioni autoimmuni e le seconde possono essere invece tollerate (3).
- Teoria degli errori Secondo questa teoria, formulata da Orgel, ogni organismo eredita un’informazione in cui è racchiuso un ‘programma’ che organizza la sua attività biologica. Nel corso della replicazione del programma si verificano degli ‘errori’ casuali che, a loro volta, possono essere responsabili di altri errori. Tali errori possono in un primo momento essere corretti, ma a volte si stabilizzano o non vengono rilevati perché di lieve entità. Lentamente tuttavia, con la ripetizione e la graduale sommazione degli errori, le conseguenze si manifestano in maniera sempre più evidente fino ad arrivare ad una vera e propria fuga dal programma e quindi al decadimento senile e più tardi alla morte. In una prima fase gli errori infatti vengono corretti, ma gradualmente si affermano e si sommano fino ad arrivare ad una ‘catastrofe di errori’ (4).
-
Teoria della perossidazione da radicali liberi Formulata da Harman (5,6) e successivamente perfezionata da altri Autori. Durante le reazioni metaboliche si formano inevitabilmente nell’organismo dei radicali liberi dell’ossigeno (ROS) (Quadro 1) che determinano alterazioni a carico delle strutture cellulari e del DNA. L’invecchiamento non sarebbe quindi altro che la conseguenza dello stress ossidativo, stress che inizierebbe fin dalla nascita (al momento cioè del primo respiro) in quanto la nostra vita aerobia, basata sul trasferimento di elettroni dal substrato all’ossigeno, produce inevitabilmente ROS. Le modificazioni generate dai ROS inducono una sere di danni, tra cui:
- idrolisi dei fosfolipidi di membrana con liberazione di acido arachidonico;
- inibizione di importanti attività enzimatiche;
- danno del DNA;
- distruzione dei mitocondri.
Queste alterazioni determinano un progressivo decadimento dell’attività cellulare.
Gli studi attuali stanno portando sempre maggiori elementi a favore della teoria dei radicali liberi, che in parte si integra, completandole, con le precedenti. Come abbia- mo visto infatti, secondo la teoria degli errori, ogni cellula possiede un’informazione nella quale è racchiuso il programma del codice genetico che ne organizza le attività e la replicazione in maniera teoricamente illimitata. Questa informazione può però subire nel tempo degli ‘inceppamenti’o ‘errori’ che ne alterano il programma. Il problema consiste pertanto nel cercare di individuare i fattori causali degli errori e, tra questi fattori, un ruolo preminente viene giocato dai ROS. Nella stessa maniera i ROS possono influire negativamente sul patrimonio immunitario alterando le sue capacità e le sue finalità.
Quadro 1
Radicali liberi dell’ossigeno
Per comprendere il concetto dei radicali liberi ricordiamo che nelle normali reazioni biochimiche si verifica una scissione asimmetrica degli elettroni (doppietto legante) che dà luogo a composti molecolari con un numero di elettroni diverso da quello dei protoni, con costituzione cioè degli ioni (scissione eterolitica) mentre, nel caso della formazione dei radicali liberi si avrà una scissione simmetrica con perdita di un solo elettrone del doppietto legante (scissione omolitica) e quindi altamente instabile che tenderà a stabilizzarsi sottraendo un elettrone ad un altro substrato.
| Ione idrossile | protoni | 17 | Radicale idrossile | protoni | 17 |
| elettroni | 18 | protoni | 17 |
L’ossigeno rappresenta un paradosso biologico in quanto, pur essendo indispensabile per la vita, costituisce un tossico potenziale in costante ricerca di elettroni atti a compensare i due orbitali impari che ruotano in periferia. Partendo come O2•• ha infatti come scopo finale quello di diventare H2O, il che può essere raggiunto attraverso differenti passi (come la sottrazione di un atomo di idrogeno ad una macromolecola quale un enzima, una proteina, il DNA o un acido grasso polinsaturo) creando però un nuovo radicale libero, e ciascun passo successivo può generare intermediari che sono più ossidanti dell’ossigeno molecolare stesso.
Particolare importanza viene data ai radicali liberi dell’ossigeno (ROS) che si formano nella catena respiratoria durante la produzione di ATP in quanto, una volta formatisi, onde stabilizzarsi i ROS tenderanno a sottrarre un elettrone (o un atomo di idrogeno, che possiede un solo elettrone orbitante) ad un’altra molecola che a sua volta tenderà a stabilizzarsi a spese di un altro substrato. Si verifica così una reazione a catena con inevitabili danni a carico dei tessuti. Particolarmente reattivo è il radicale idrossile (OH•) che si forma nella catena respiratoria, il quale, se non viene neutralizzato dagli agenti antiossidanti, inizia la perossidazione del DNA, di alcune proteine enzimatiche e degli acidi grassi polinsaturi della membrana (alterandone la funzionalità) e delle LDL (le lipoproteine che trasportano il colesterolo rendendole incapaci di riconoscere i recettori cellulari).
Tabella 1 Stress ossidativo da radicali liberi dell'ossigeno
Perossidazione lipidica
|
Ossidazione e deplezione del glutatione ridotto
|
Ossidazione e deplezione dei tioli proteici
|
Alterazione dell'omeostasi ionica
|
Danno al DNA
|
Alterazioni citoscheletriche e mitocondriali (acidi grassi polinsaturi)
|
Deplezione di ATP
|
Aumentata permeabilità della membrana plasmatica
|
MORTE DELLA CELLULA
Tabella 2 Catena di formazione di radicali liberi
| R• | + | PUFA | = | PUFA• | + | RH |
| PUFA• | + | O2 | = | PUFA-O-O• | ||
| PUFA-O-O• | + | PUFA• | = | PUFA-O-O |
Nel nostro organismo avvengono continuamente ed ubiquitariamente reazioni che portano alla formazione di radicali liberi, ma nonostante ciò noi non ci accorgiamo della loro formazione perché siamo protetti da agenti antiossidanti di cui alcuni sono costituzionalmente presenti nel nostro organismo (prima linea di difesa), mentre altri vengono assunti con l'alimentazione (seconda linea di difesa). E' necessario però proteggere costantemente il nostro organismo dal rischio dello stress ossidativo cercando di combattere i fattori pro-ossidanti, di limitare il substrato perossidabile, e di aumentare gli agenti antiossidanti. Non potendo noi interferire sul patrimonio genetico, cioè sulla prima linea di difesa, dovremo perciò (oltre a preve- nire i fattori pro-ossidanti) cercare di favorire l'assunzione degli agenti antiossidanti attraverso una alimentazione corretta, fondamentale salvaguardia contro l'evoluzione del processo di invecchiamento, agendo cioè sulla seconda linea di difesa in maniera da consentire il mantenimento di una situazione di equilibrio. Si tratta comunque di un equilibrio instabile che può alterarsi per il prevalere di diversi fattori causali che determinano lo stress ossidativo che può essere definito come una condizione nella quale l'esposizione ai ROS crea un disturbo per la normale funzione della cellula, o addirittura, per la sua normale sopravvivenza (Tab 1).
Tali fattori causali possono essere esterni od interni all'organismo.
- Fattori causali esterni: aumentata tensione di ossigeno, inquinamento atmosferico, fumo di sigarette, eccessiva esposizione ai raggi solari;
- Fattori causali interni: obesità, carenza proteica, alcol, assunzione di metalli pesanti (ferro, rame), eccessivo consumo di acidi grassi polinsaturi, insuffi- ciente introduzione di agenti antiossidanti, eccessiva attività fisica.
Durante i normali processi metabolici per la sintesi di ATP a livello della catena respiratoria mitocondriale, il 2-5% dell'ossigeno non arriva alla sua completa riduzio- ne ad acqua, ma forma dei prodotti intermedi altamente reattivi, quali i radicali liberi superossido ed idrossile. Radicali liberi si formano inoltre nel corso dei processi infiammatori e durante la sintesi delle prostaglandine e dei leucotrieni. Una volta formatisi, i ROS tendono a stabilizzarsi per sottrazione di un atomo di idrogeno molecolare ad un altro substrato creando però un altro radicale, determi- nando così la ripetizione e la propagazione del ciclo con reazione radicalica a catena. Una particolare labilità a cedere un atomo di idrogeno è caratteristica degli acidi grassi polinsaturi (PUFA) che, a loro volta, possono trasformarsi in radicali liberi (Tab 2). I radicali liberi degli acidi grassi polinsaturi possono successivamente reagire con l'ossigeno molecolare per formare ulteriori radicali liberi perossidati e possono quindi propagare il processo ad altri acidi grassi polinsaturi per dare luogo a nuovi radicali liberi, ad idroperossidi e a prodotti di degradazione, come la malonildialdeide, con inevitabili danni, anche gravi, all'economia dell'organismo. La reazione terminerà con la formazione di un polimero o per l'intervento di un antiossidante.
Pertanto, se la presenza degli acidi grassi polinsaturi nei fosfolipidi di membrana rappresenta un requisito per la struttura e la funzionalità cellulare, tale presenza rappresenta nello stesso tempo una sorgente potenziale di danno per la facilità con la quale i polinsaturi possono andare incontro ai processi perossidativi. L’invecchiamento si accompagna infatti ad un accumulo intracellulare di lipofuscina, un pigmento risultante dalla polimerizzazione dei polinsaturi perossidati. Tali alterazioni rivestono particolare importanza a livello del sistema nervoso centrale dove le alterazioni funzionali da cui dipendono la permeabilità, le attività e le funzionalità recettoriali, possono accelerare il processo di invecchiamento cerebrale con danni riflessi a tutto l’organismo.
La nostra vita aerobia, basata sul trasferimento di elettroni dai substrati all’ossigeno, produce inevitabilmente radicali liberi e pertanto, quanti più polinsaturi saranno presenti nelle membrane cellulari e nelle lipoproteine, tanto più avremo la possibilità di formare idroperossidi, che si possono considerare un prodotto terminale della perossidazione, ma anche un prodotto iniziale perché dalla loro degradazione si possono formare nuovi radicali.
Una volta danneggiati ed innescata la reazione a catena, i radicali liberi lipidici reagiscono con l’ossigeno moleco- lare per formare lipoperossidi instabili che subiscono rapidamente la degenerazione catalizzata dai metalli liberando frammenti carbonilici che si incrociano e polimerizzano le molecole cellulari essenziali. Questi processi portano alla formazione di composti fluorescenti che si accumulano durante l’invecchiamento.
Va inoltre sottolineato che, con l’avanzare degli anni, si verifica una sempre maggiore sensibilità delle membrane biologiche ai fenomeni perossidativi, con una progressiva diminuzione della loro funzionalità. Nello stesso tempo aumenta l’attività della fosfolipasi A2, l’enzima che a livello di membrana idrolizza i fosfolipidi liberando acido arachidonico (C20:4 ω-6), il che determina un aumento della formazione del trombossano (con vasocostrizione e iperaggregabilità piastrinica) e dei leucotrieni (con accentuazione della flogosi e della disfunzione endoteliale) con diminuzione del potere immunitario ed aumento del danno vascolare cui consegue, oltre al rischio delle neoplasie e delle cardiovasculopatie, una diminuzione dell’apporto di nutrienti ai tessuti.
In conclusione, l’ossigeno è un paradosso biologico, ind spensabile per la vita e la produzione di energia, ma responsabile anche delle alterazioni perossidative (ubiquitarie e continuative) che conducono alla morte.
La formazione dei prodotti intermedi del metabolismo dell’ossigeno (radicali liberi, perossidi, aldeidi) è infatti, per molti aspetti, un fatto inevitabile, che determina un danno a carico del DNA rendendo irriconoscibile la lettura del codice.
L’iperossigenazione, e quindi l’innesco dei fenomeni perossidativi, sarebbe stata responsabile di un evento storico letale che avrebbe determinato nell’era preistorica la scomparsa dei dinosauri, come è stato sostenuto da R Berner (Università di Yale) e G Landis (Laboratorio Geologico di Denver), i quali, dopo aver analizzato resine fossili risalenti ad 80 milioni di anni fa, hanno concluso che la percentuale di ossigeno dell’atmosfera terrestre sarebbe stata per un certo periodo molto più elevata di quella attuale (50% contro il 20%), il che avrebbe determinato conseguenze enormi tra i rettili che allora popolavano la terra portandoli alla loro estinzione. Gli studiosi hanno proceduto quindi con le loro ricerche studiando la composizione dell’aria di due ambre, di cui una risalente a 25 milioni di anni fa, dimostrando una composizione dell’aria che si sarebbe successivamente modificata divenendo del tutto simile a quella che respiriamo attualmente (7).
ANTIOSSIDANTI E ALIMENTAZIONE
Come già detto, noi siamo costantemente esposti al rischio perossidativo, tuttavia viviamo in uno stato di apparente benessere in quanto esistono degli agenti anti- ossidanti che proteggono l’organismo. Accanto ai geni antiossidanti anti-invecchiamento di natura costituzionale congenita, che caratterizzano la specie umana, notevole importanza assumono gli antiossidanti assunti con l’alimentazione (Tab 3).
Tabella 3 Fattori protettivi contro i radicali liberi dell'ossigeno
| Costituzionali | Nutrizionali |
| Superossido dismutasi | α-tocoferolo |
| Catalasi | β-carotene |
| Glutatione- perossidasi | Acido ascorbico |
| Acido urico | Carotenoidi |
| α-1-antitripsina | Composti fenolici |
| Transferrina | Selenio |
| Ferritina | Zinco |
| Bilirubina |
Tra gli antiossidanti assunti con l’alimentazione, vanno ricordati la vitamina E (α-tocoferolo), la pro-vitamina A (β-carotene), la vitamina C (acido ascorbico), i carotenoidi idrocarboniosi (α-carotene, licopene, luteina), i carotenoidi contenenti ossigeno, o xantofille (luteina e la zeaxantina), i composti fenolici (fenil-acidi, fenil-alcoli, secoiridoidi, antociani, flavonoidi, lignani), l’ubichinolo, il selenio e lo zinco ed alcuni aminoacidi come la metionina e la cistina, ma esistono anche altri antiossidanti che potremmo definire ‘minori’ come lo squalene, un idrocarburo triterpenico presente nell’olio di oliva.
Onde mantenere in equilibrio la bilancia ossidativa, oltre ad insistere sulla necessità di evitare l’esposizione ai fattori pro-ossidanti esterni ed interni, si ribadisce l’importanza di un’alimentazione ricca in sostanze antiossidanti, che sono contenute prevalentemente nella frutta e nella verdura, ma anche nei loro derivati quali l’olio di oliva extravergine, il tè verde, il caffè, il cacao ed il vino (inteso quest’ultimo in quantità adeguate, vale a dire non più di 500 mL pro/die nel maschio e 330 mL nella femmina, in quanto l’alcol in eccesso annulla gli effetti benefici dei polifenoli ed inverte il fenomeno in senso pro-ossidante). Nello stesso tempo si dovrà anche cercare di limitare i fattori dietetici che possono favorire la formazione dei radicali liberi come la carenza proteica, l’eccesso calori- co, l’eccesso alcolico, alcuni minerali come il rame ed il ferro, e soprattutto, come si è detto, gli acidi grassi polinsaturi. Quanto a questi va però precisato che quelli esposti al rischio perossidativo appartengono alla serie ω-6, e non alla serie ω-3. Gli ω-6 infatti tendono a cedere ai ROS un atomo di idrogeno (onde stabilizzarli), diventando però a loro volta dei radicali ed arrivare alla formazione di idroperossidi, i quali possono essere considerati un prodotto terminale della perossidazione, ma anche un prodotto iniziale perché dalla loro degradazione si possono formare nuovi radicali con sovvertimento delle strutture cellulari e danni al DNA.
Al contrario, gli ω-3 sembrano non essere suscettibili alla perossidazione indotta dai ROS ed anzi avrebbero dimostrato addirittura un’azione inibente sul meccanismo perossidativo, dimostrando un effetto protettivo sul sistema vascolare, sull’attività cerebrale e sul rischio neopla- stico (8,9). Questo effetto protettivo, definito come un effetto paradosso, si verificherebbe per l’intervento di alcuni metaboliti dell’acido α-linolenico (18:3 ω-3) dotati di potente azione antiossidante (in particolare la prosta- glandina PGI3). Qualora non venga inattivato dagli agenti antiossidanti, l’arresto del processo perossidativo degli acidi grassi polinsaturi ω-6 può avvenire attraverso la formazione di polimeri, cioè di composti ciclici, i quali possono determinare lesioni di tipo ulcerativo con accumulo di pigmenti formati da lipofuscina e ceroidi (mac- chie brune) e tendenza alla comparsa di neoplasie.
Polinsaturi a lunga catena e competizione ω-6/ω-3
L’attività biologica degli acidi grassi polinsaturi non è legata direttamente all’acido linoleico (18:2 ω-6) ed all’acido α-linolenico (18:3 ω-3), cioè ai composti a 18 atomi di carbonio assunti abitualmente attraverso gli oli di oliva e di semi, bensì prevalentemente ai loro derivati superiori a lunga catena a 20 e 22 atomi di carbonio, che si formano nell’organismo dopo la loro assunzione, grazie agli enzimi elongasi e denaturasi (Fig 1). Tali acidi grassi a lunga catena sono il diomo-γ-linolenico (GLA; 20:3 ω-6), l’arachidonico (AA; 20:4 ω-6), l’eicosapentaenoico (EPA; 20:5 ω-3) ed il docosaesaenoico (DHA; 22:6 ω-3): questi polinsaturi sono biologicamente attivi e devono anche essi giungere direttamente preformati alla cute la quale non possiede gli enzimi deputati all’allungamento ed alla ulteriore desaturazione della catena. Nell’organismo esiste poi un conflitto di attività tra la serie linoleica (ω-6) e la serie linolenica (ω-3), così come esiste anche un conflitto competitivo per gli enzimi elongasi e desaturasi.
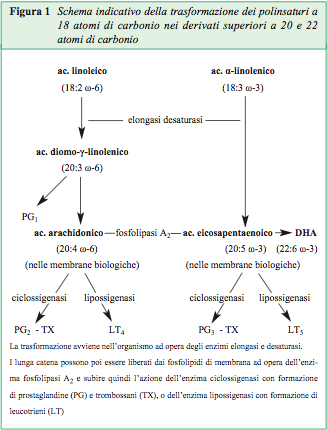
La presenza nella dieta di elevate percentuali di acido linoleico (18:2 ω-6), come accade con l’assunzione degli oli di semi, tenderà quindi a sottrarre le desaturasi all’acido α-linolenico (18:3 ω-3) favorendo la formazione di AA al posto degli acidi EPA e DHA riducendo il potere immunitario e aumentando il rischio vascolare.
Gli acidi a lunga catena si pongono nei fosfolipidi delle membrane biologiche, dove svolgono le loro funzioni strutturali. Dalle membrane possono poi essere poi scissi ad opera dalla fosfolipasi A2 e successivamente, per opera dell’enzima ciclossigenasi, possono formare le prostaglandine (che svolgono numerose attività, in parte positive ed in parte negative) ed i trombossani (che svolgono attività pro-aggregante piastrinica) e, per opera della lipossigenasi, formare i leucotrieni (che svolgono attività pro-flogistica). Mentre i trombossani ed i leucotrieni che derivano dall’AA (ω-6) sono particolarmente attivi, i trombossani ed i leucotrieni che derivano dall’EPA (ω-3) sono scarsamente attivi, facendo comprendere un’azione protettiva degli omega-3, la cui assunzione deve essere perciò favorita.
Non si dovrà quindi eccedere con i polinsaturi ω-6 (oli di semi, margarine molli), ma precisiamo che non si dovrà eccedere neppure con gli acidi grassi saturi di cui sono ricchi i grassi degli animali (burro, strutto) in considera- zione della loro azione ipercolesterolemizzante e forse anche cancerogena.
Stabilito il fabbisogno fisiologico di acidi grassi polinsaturi, la scelta andrà perciò indirizzata verso i monoinsaturi che appaiono resistenti all’innesco perossidativo, e quindi verso l’olio di oliva, in particolare nella qualità extravergine che, accanto alla equilibrata composizione in acidi grassi polinsaturi e monoinsaturi, possiede una notevole ricchezza in agenti antiossidanti quali l’α-tocoferolo, i polifenoli ed i carotenoidi (10). I monoinsaturi possono inoltre entrare nella composizione dei fosfolipidi della membrana conferendo a quest’ultima tutte le carat- teristiche termodinamiche dei polinsaturi, senza nel contempo causare l’aumento del rischio perossidativo (11). Accanto all’apporto dei monoinsaturi come fonte principale di acidi grassi, sarà comunque utile aumentare l’assunzione degli ω-3 anche attraverso il consumo di pesce che contiene gli omologhi superiori a 20 e 22 atomi di carbonio preformati (EPA e DHA), associando sempre un adeguato apporto di agenti antiossidanti onde evitare possibili interventi perossidativi anche a carico degli ω-3.
Senescenza e funzioni cerebrali
La protezione del cervello è fondamentale nella prevenzione dell’invecchiamento in quanto il cervello irraggia la sua attività su tutti gli organi ed apparati ed il suo decadimento costituisce la base principale del decadimento generale dell’organismo.
Ricordiamo che nel sistema nervoso grande importanza riveste l’interazione tra neurone e neurone.
La trasmissione dei messaggi avviene infatti attraverso l’attivazione di processi biochimici intramembranari che coinvolge specifici fosfolipidi di membrana e pertanto l’integrità funzionale delle membrane appare fondamentale per la corretta elaborazione di tali messaggi e per la complessa attività che ad essa ne consegue. Poiché lo stato chimico-fisico delle membrane condiziona la permeabilità, le attività enzimatiche e la funzionalità recettoriale dalle quali dipendono le interazioni neuronali, le modificazioni provocate dall’innesco perossidativo e dalla susseguente reazione a catena possono danneggiare l’encefalo e favorire il processo di invecchiamento.
E’ del resto facilmente ipotizzabile che durante l’invecchiamento possano intervenire mutazioni anche notevoli dei meccanismi di trasmissione sinaptica, non dimenticando che tale trasmissione richiede, oltre alla presenza dei neurotrasmettitori, anche l’integrità strutturale delle membrane.
Non va dimenticato infine che nel cervello esiste una elevata concentrazione di acidi grassi polinsaturi a lunga catena (in particolare degli ω-3) necessaria per l’attività dei neuroni e la trasmissione degli impulsi. Tenendo conto che il cervello ha un elevatissimo consumo di ossigeno, pari al 20% dell’ossigeno totale consumato dall’organismo, è evidente che quest’organo è particolarmente esposto al rischio perossidativo ed ha bisogno quindi di una elevata protezione antiossidante.
PROTEZIONE CONTRO IL RISCHIO PEROSSIDATIVO
Attualmente l’interesse degli studiosi, oltre che ai rapporti tra i ROS e l’evoluzione dell’invecchiamento, si sta rivolgendo anche ai rapporti tra i ROS e la patogenesi di numerose malattie, tra cui principalmente le malattie cronico degenerative (aterosclerosi e neoplasie) che possono contribuire a ridurre la speranza di vita.
Da quanto esposto appare evidente la necessità di non fumare, di evitare gli ambienti inquinati, di evitare l’esposizione incontrollata al sole, di controllare la pres- sione arteriosa, di combattere l’obesità e di non effettuare attività fisica intensa se non si è allenati. Nello stesso tempo appare anche evidente la necessità di assumere quotidianamente alimenti ricchi in antiossidanti come i vegetali che devono essere freschi, maturi e pigmentati e si precisa a questo proposito che il licopene è presente nei pomodori rossi e non in quelli verdi e che l’acido folico (utile per favorire il mantenimento della memoria) è presente in particolare nelle foglie verdi. Gli oli ricchi in acidi grassi polinsaturi della serie ω-6 (acido linoleico) vanno mantenuti nel fabbisogno indispensabile, pari al 6% della quota lipidica (2% delle calorie totali), mentre vanno favoriti gli alimenti ricchi in acidi grassi ω-3, in particolare i derivati superiori a lunga catena, quali l’EPA e il DHA, presenti soprattutto nel pesce azzurro, cercando di mantenere un rapporto tra la serie ω-6 e la serie ω-3 pari a 10:1 (Tab 4), rapporto che da molti Autori viene ritenuto migliore, nell’età senile, pari a 5:1. In Italia il rapporto ω-6/ω-3 si aggira intorno a 13:1, insufficiente, ma sicuramente migliore di quello di altri paesi occidentali dove corrisponde a 20:1 ed in certi casi anche a 30:1.
Come fonte energetica, accanto al fabbisogno fisiologico di polinsaturi, andranno assunti i monoinsaturi (acido oleico), resistenti all’azione dei ROS e che recenti acquisizioni scientifiche hanno dimostrato svolgere attività antiaterogena ed antitumorale ed è stato anche evidenziato, con controlli su individui a differente introduzione di olio di oliva, che un elevato apporto di monoinsaturi (in quantità superiore a 50 g pro/die) esercita una significativa protezione sul mantenimento delle funzioni cognitive (12).
Olio di oliva extravergine
Per molto tempo le attività protettive dell’olio di oliva sono state attribuite solo alla sua composizione acidica, ricca in monoinsaturi, con un contenuto ottimale in polin- saturi ω-6 ed ω-3.
Le attuali conoscenze però, pur senza escludere l’importanza biologica della composizione acidica equilibrata, hanno dimostrato che il valore salutistico dell’olio di oliva, nella sua qualità di extravergine, è legato prevalentemente alla presenza dei componenti minori, la maggior parte dei quali sono dotati di potere antiossidante, come l’α-tocoferolo, alcuni carotenoidi, i fitosteroli, le feofitine, gli idrocarburi triterpenici (squalene) ed i composti fenolici (Tab 5).
Il maggiore interesse degli studiosi viene oggi rivolto ai composti fenolici, chiamati abitualmente polifenoli, i quali, oltre al loro potere antiossidante, presentano numerose altre attività protettive nei confronti dell’organismo. Caratterizzati dal possedere un nucleo flavonico, sono numerosissimi e molto diffusi nel regno vegetale. L’olio di oliva ne contiene diverse classi, quali i fenil-acidi, i fenil-alcoli, i flavonoidi, i secoiridoidi ed i lignani.
In particolare, tra i flavonoidi troviamo la luteolina, la rutina, gli antociani (cianidina e delfinidina-glucoside), tra i fenil-alcoli troviamo il tirosolo e l’idrossitirosolo, tra i fenil-acidi l’acido caffeico, clorogenico, vanilico e ferulico e, tra i secoiridoidi l’oleoeuropeina, la demetiloleoeuropeina ed il ligustroside.
I polifenoli possono essere liposolubili ed idrosolubili e quindi agire sia nei comparti lipofili (membrane biologiche e lipoproteine) che nei comparti idrofili (sangue e tessuti). L’olio di oliva è l’unico grasso alimentare che contenga, accanto ai polifenoli lipofili, importanti sostanze polifenoliche idrofile le quali si originano durante il processo di estrazione meccanica dell’olio dai polifenoli glucosidici presenti nell’oliva (13).
Tabella 4 Rapporto ω-6/ω-3 in alcuni grassi alimentari
| Oli | linoleico | α-linolenico | rapporto ω-6/ω-3 |
| olio di arachidi | 27.87 | ---- | 27 : 0 |
| olio di girasole | 48.89 | 0.33 | 150 : 1 |
| olio di mais | 49.83 | 0.60 | 80 : 1 |
| olio di oliva | 7.85 | 0.99 | 8 :1 |
| olio di sesamo | 41.90 | 0.30 | 130 : 1 |
| olio di soia | 51.36 | 7.60 | 7 :1 |
| olio di vinacciolo | 41.90 | 0.30 | 130 : 1 |
| INRAN (2000) |
Tabella 5 Composizione in acidi grassi dell’olio di oliva
| Acidi grassi | % |
| saturi (palmitico, stearico) | 8 - 14 |
| monoinsaturi (oleico) | 68 - 82 |
| polinsaturi ω-6 (linoleico) | 6 - 13 |
| polinsaturi ω-3 (α-linolenico) | 0.2 - 1.5 |
Componenti minori nell’olio di oliva extravergine
Tocoferoli (vitamina E)
Carotenoidi (β-carotene, luteina)
Fitosteroli (β-sitosterolo)
Polifenoli (idrossitirosolo, oleoeuropeina, lignani)
Idrocarburi triterpenici (squalene)
Clorofilla
Composti aromatici
Sono presenti poi nell’olio extravergine, anche se in quantità non elevata, alcuni carotenoidi come il β-carotene e la luteina (responsabili del colore giallo). Oltre alle note attività del β-carotene antiossidanti e protettive della cute, recenti pubblicazioni hanno evidenziato un ruolo della luteina (accanto all’attività protettiva contro la cataratta e la degenerazione senile della retina) nel proteggere questo tessuto favorendone l’idratazione, lo spessore e la densità, ritardando i fenomeni di invecchiamento (14). Non va infine dimenticato che l’olio di oliva favorisce a livello intestinale l’assorbimento dei carote- noidi, ed in particolare del licopene (attivissimo contro il foto-invecchiamento cutaneo ed il rischio vascolare e neoplastico dei tessuti) ma anche della luteina (15), con la quale inoltre il licopene sembra agire sinergicamente (16,17).
Accanto ai polifenoli ed ai carotenoidi, molto importante è anche la presenza, nell’insaponificabile dell’olio extra- vergine, di quantità piuttosto rilevanti di un idrocarburo triterpenico, lo squalene il quale, oltre agire proteggendo la cute come filtro dei raggi UV, svolge attività protettiva antiossidante ed antitumorale (18).
CONCLUSIONI
Secondo le più accreditate teorie la principale causa del- l’invecchiamento sarebbe determinata dai danni cellulari subiti ad opera dei ROS durante tutto l’arco della vita e, tra i fattori causali una grande responsabilità va attribuita agli errori alimentari. Numerosi studiosi si sono succeduti nel tempo a ripetere che la dieta deve essere limitata nelle calorie e controllata nella sua composizione, ma i suggerimenti sono stati sempre empirici e spesso contraddittori. Si è dovuto attendere l’affacciarsi delle conoscenze immunologiche e soprattutto le conoscenze dell’azione dei radicali liberi dell’ossigeno per comprendere come e quanto un tessuto, teoricamente destinato ad una replicazione illimitata, finisca con il cedere alle insidie del tempo.
Certamente l’evoluzione della senescenza è molto com- plessa e multifattoriale. Numerose sono infatti le componenti biologiche ed ambientali che contribuiscono alla sua evoluzione, ma l’attività perossidativa svolta dai ROS sulle macromolecole (in particolare sui polinsaturi ω-6) sta assumendo ogni giorno di più un preciso significato patogenetico, così come nello stile di vita appare importante il mantenimento delle attività sociali ed intel- lettive.
Ci sembra quindi di poter concludere raccomandando di rispettare la Dieta Mediterranea, rappresentata da un ele- vato consumo di vegetali freschi, maturi e pigmentati che assicurano un’adeguata introduzione di antiossidanti, di vitamine, di minerali e di fibre. Un posto di rilievo viene assunto dall’olio di oliva extravergine, per la ricchezza in polifenoli ed altri antiossidanti e per l’equilibrata compo- sizione in acidi grassi (19). Si devono assumere inoltre i carboidrati complessi (con limitazione dei carboidrati semplici) ed una certa quantità di proteine animali (onde favorire l’assunzione degli aminoacidi essenziali, della vitamina B12, del ferro e del calcio biodisponibili); un posto di rilievo va dato al pesce (in particolare sardine, sgombri e tonno), per la ricchezza in polinsaturi ω-3 a lunga catena.
Dovrà infine essere evitato l’eccesso calorico e l’abuso alcolico, ma può essere concessa una moderata quantità di vino, meglio se vino rosso.
BIBLIOGRAFIA
1 Garotta G (1983)
Aspetti biologici dell’invecchiamento. In: Decadimento cerebrale
senile Farmitalia, C. Erba Editori, Milano, p 9-32
2 Hayflick L (1986)
Origin of longevity. In: Modern biological theories of aging Warner HL, Butler AH, Collins KJ Eds, Cambridge Un Press, Cambridge, p 181-199
3 Walford RL (1969)
The immunologic theory of Aging
Munskgaard, Copenagen
4 Orgel LE (1973)
Aging of clones of mammalian cells
Nature 243 441-445
5 Harman D (1956)
Aging, a theory based on free radical and radiation chemistry J Gerontol 11 298-300
6 Harman D (1988)
Free Radical Theory of Aging. In: The Molecular Mechanisms of Aging. Role of Dietary Lipids Medical Scientific Meeting, Lucca, Italia, p 15-27
7 Berner R, Landis G (1988)
citati su Medicina e Dossier p 35
8 Din JN, Newby DE, Flapan AD (2004)
Science, Medicine, and Future: Omega-3 fatty acids and cardiova- scular diseases – Fishing for a Natural Treatment BMJ 328 30-35
9 Sinopoulos AP (2002)
Omega-3 fatty acids in inflammation and autoimmune diseases
J Am Coll Nutr 21 495-505
10 Atti Congresso Accademia Nazionale dell’Olivo e dell’Olio
(2006)
Gli antiossidanti degli oli vergini di oliva con particolare riferimen- to ai composti fenolici e alla loro importanza biologica Spoleto, PG, Italia, 10 Giugno
11 Sevanian A (1988)
The impact of lipid unsaturation and autoxidation on membrane structure. In: Meccanismi molecolari dell’invecchiamento. Ruolo dei lipidi alimentari Medical Scientific Meeting, Lucca, Italia, p 46-54
12 Scott Grundy M (1989)
Trattamento dietetico dell’iperlipidemia. In: Ipercolesterolemia ed aterosclerosi Edizioni Momento Medico, Roma, p 159-182
13 Servili M, Selvaggini R, Esposto S, Taticchi A, Urbani S, Montedoro GF (2006) La composizione fenolica dell’olio di oliva e dell’olio vergine. In: Gli antiossidanti degli oli vergini d’oliva con particolare riferimen- to ai composti fenolici e alla loro importanza biologica Atti Cong Accademia Nazionale dell’Olivo e dell’Olio, Spoleto, Italia, 10 Giugno, p 7-26
14 Chen J, Wu A, Pathak M, Rius-Diaz F, Mihm C et al (2002) Dietary lutein and zeaxanthin partially prevent UVB-induced skin carcinogenesis in Skh-1 hairless mouse model (Abstract 767) Soc Invest Dermatol 63rd Annual Meeting Los Angeles, CA-USA
15 Laskshiminarayana R, Raju M, Keshava Prakash MN, Bakaran V (2009)
Phospholipid, oleic acid micelles and dietary olive oil influence the lutein absorption and activity of antioxidant enzymes Lipids 44 799-806
16 Lee EH, Faulhuber D, Hanson KM, Dug W, Peters S et al (2004) Dietary Lutein reduce ultraviolet radiation-induced inflammation and immunosoppression J Invest Dermatol 122 510-517
17 Clark RM, Yao L, She L, Furr HC (2000)
A comparison of lycopene and astaxanthin absorption of from corn oil and olive oil emulsion Lipids 37 803-806
18 Kelly G (1999)
Squalene and its potential clinical uses
Altern Med Rev 4(1) 29-36
19 Viola P, Audisio M (1997)
Lipidi alimentari e invecchiamento
Enciclopedia Mondiale dell’Olivo Consejo Oleicolo Internacional Editore, Madrid, Spagna, p 378
