NOTIZIARIO Aprile 2012 N°4
"EVIDENZE SUL DECLINO COGNITIVO"
parte I°
A cura di:
Giuseppe Di Lascio §
Susanna Di Lascio***
Con la collaborazione di:
Invecchiamento e declino cognitivo
Molti anziani, pur se centenari, sembrano non presentare alcun declino cognitivo nella loro vita. Purtroppo, però, con ampie differenze nella popolazione è comune osservare con l’invecchiamento alterazioni in tal senso. La cognizione, di fatto, comprende una combinazione di competenze mentali, quali l’attenzione, l’apprendimento, la memoria, il linguaggio, le capacità motorie e quelle visuospaziali, l’orientamento, le funzioni esecutive con capacità della definizione degli obiettivi, la loro pianificazione e il giudizio critico. La bassa velocità di elaborazione delle informazioni, che può causare il deficit di altre funzioni cognitive, è, in effetti, un segno distintivo del normale invecchiamento, ma non ancora del tutto chiarita rimane la causa dei cambiamenti strutturali del cervello in età apparentemente normale. Si riconoscono, invero, tre tipi di declino cognitivo con la senescenza:
1. l’AAMI (Age-associated Memory Impairment), caratterizzata da una lieve compromissione della memoria che può verificarsi con l'invecchiamento normale e che non può essere rilevata con test psicometrici obiettivi nella fascia di età delle persone considerate;
2. la MCI (Mild Cognitive Impairment), caratterizzata da una lieve perdita di memoria rilevabile con test psicometrici obiettivi per la fascia di età;
3. la demenza, che include la malattia di Alzheimer, cronica, progressiva, irreversibile, con deterioramento cognitivo globale e con la perdita di memoria che sono abbastanza gravi tanto da pregiudicare le funzioni quotidiane dei malati.
Il progressivo aumento della speranza di vita, che sta comportando un aumento esponenziale del numero degli anziani con cambiamenti fondamentali nella struttura della popolazione e profonde influenze sulla società contemporanea, rappresenta un fattore determinante di questo settore della medicina per la crescita d’interesse sul piano della ricerca e sulla pratica professionale.
Sull’inizio del processo del declino cognitivo vi è un acceso dibattito tra gli studiosi in mancanza di biomarcatori affidabili che indichino il maggior rischio della malattia. In effetti, le indicate caratteristiche patologiche della demenza rappresentate dai grovigli neurofibrillari e dalle placche amiloidi, si ritrovano anche nel cervello dei giovani adulti. Diversi studi clinico-patologici hanno, però, dimostrato una buona correlazione tra la neuropatologia e la gravità del declino cognitivo. Pur tuttavia, in rapporto alla rarità dei dati di studi longitudinali che possano estendersi per molti decenni, la valutazione degli effetti dell'età sul declino cognitivo non è semplice. A tutto oggi, vi è la sola evidenza che il controllo dei fattori tradizionali del rischio cardiovascolare può avere un effetto benefico sulla prevenzione della demenza.
Il DCL o declino cognitivo lieve
Il termine Il DCL o declino cognitivo lieve è entrato in uso dal 2000 circa ed è basato in gran parte sui lavori di Ron Petersen della Mayo Clinic, Rochester, Minnesota e collaboratori. In un primo studio prospettico, di coorte longitudinale di settantasei soggetti, confrontati con 234 controlli sani e 106 pazienti con lieve malattia di Alzheimer (AD), gli Autori hanno misurato le funzioni cognitive con diversi strumenti diagnostici (Arch Neurol. 1999;56:303-308). La distinzione principale tra i soggetti di controllo e quelli con il DCL o declino cognitivo lieve si otteneva nella zona della memoria, mentre le altre funzioni cognitive erano comparabili. Tuttavia, quando i soggetti con DCL o declino cognitivo lieve erano confrontati con i malati di Alzheimer molto lieve, le prestazioni della memoria erano simili, ma questi ultimi presentavano maggiore compromissione degli altri domini cognitivi. Le prestazioni nel tempo dimostravano anche che nei soggetti con DCL si riducevano con un tasso superiore a quello dei controlli, ma meno rapidamente rispetto ai pazienti con malattia di Alzheimer lieve. Gli Autori, così, concludevano che i pazienti che soddisfacevano ai criteri per il DCL potevano essere differenziati dai controlli sani e da quelli con AD molto lieve, appartenendo a un’entità clinica indipendente.
Gli AA, difatti, considerando che il deterioramento cognitivo dovesse caratterizzare le prime fasi della demenza nell’anziano e sulla base delle evidenze di uno stato di transizione tra i cambiamenti cognitivi del normale invecchiamento e la malattia di Alzheimer (MA), hanno delineato il DCL come condizione clinica tra la senescenza normale e la MA (Arch Neurol. 2001;58:1985-1992). In tale caso le persone sperimentano la perdita di memoria in misura maggiore di quanto ci si aspetterebbe per l’età, senza soddisfare i criteri della MA clinicamente probabile. Pur tuttavia, nel tempo tali soggetti potrebbero progredire con un ritmo molto accelerato verso una forma di MA clinicamente probabile, rispetto ai sani di pari età. Di conseguenza, questa condizione è stata riconosciuta idonea per un eventuale intervento terapeutico, stimolando l’interesse di un gruppo di esperti in tutto il mondo nei settori della neurologia, psichiatria, geriatria, neuropsicologia, neuroimaging, neuropatologia. Così che oggi la lieve insufficienza cognitiva è ritenuta una condizione ad alto rischio di sviluppo della MA clinicamente probabile, indicando, come accennato, quelle persone che hanno, solitamente ma non sempre, lievi sintomi progressivi con cambiamenti peggiorativi nelle abilità mentali e della memoria. In un’analisi definitiva, negli ultimi dieci anni si è costatato, peraltro, che un gran numero di questi malati, ma certamente non tutti, tende a progredire verso la demenza di Alzheimer. Pertanto, si è sempre più sviluppato l’interesse nei riguardi del DCL con la costituzione anche di due serie di criteri di gruppi di lavoro a essa dedicati: il primo fondamentalmente clinico, relativo all’uso dei fornitori senza accesso agli strumenti avanzati di analisi d’immagine o di CSF (cerebro spinal fluid), il secondo, adeguato alla ricerca e alla descrizione dei biomarcatori per il loro uso sperimentale e per l’impostazione clinica.
Comunque, l'ultima serie di criteri per la definizione del deterioramento cognitivo lieve, secondo Petersen nel 1999, si basa su quattro livelli di certezza, secondo la presenza e la natura dei risultati dei biomarker:
1. Preoccupazione nei riguardi di un cambiamento dello stato cognitivo identificato dal paziente, da un informatore o da un clinico esperto.
2. Compromissione della performance cognitiva che dovrebbe risultare inferiore a quanto previsto per l'età e l'istruzione con una gradualità di peggioramento nel tempo.
3. Conservazione d’indipendenza nelle capacità funzionali, ma meno efficienti e con più errori nelle attività quotidiane.
4. Assenza di demenza, ma con variazioni sufficientemente miti senza alcuna evidenza di compromissione sociale o lavorativa.
La β-amiloide può predire il declino cognitivo?
I recenti progressi nella neuroimaging cerebrospinale, nel liquido cefalorachidiano (CSF) e su altri biomarker forniscono oggi giorno la capacità di individuare i segni del processo fisiopatologico della MA in vivo. Dati emergenti in individui anziani clinicamente normali suggeriscono che la verifica dell’accumulo della β-amiloide (βA) si associa funzionalmente e strutturalmente alle alterazioni cerebrali in linea con i modelli delle anomalie osservate nei pazienti con decadimento cognitivo lieve (DCL) e la demenza Alzheimer (MA). Inoltre, studi di coorte clinica suggeriscono che ci possono essere alterazioni cognitive molto sottili rilevabili già anni prima che si risponda ai criteri per il DCL e che facciano prevedere la progressione verso la MA. È anche chiaro, tuttavia, che alcuni individui più anziani, che presentano il processo fisiopatologico della MA, non arriveranno mai a diventare sintomatici durante la loro vita. Pertanto, allo stato attuale si rileva la fondamentale necessità di meglio definire il biomarker e / o il profilo cognitivo che meglio possa predire la progressione dalla fase preclinica a quella clinica del DCL verso la MA. Invero, la lunga fase preclinica della MA fornirebbe già un'opportunità critica per l’intervento potenziale della terapia che possa modificare il decorso della malattia, se si fosse in grado di chiarire il legame tra il processo fisiopatologico della MA e la comparsa della sindrome clinica.
In effetti, la diagnosi clinica delle malattie neurodegenerative, quali il morbo di Alzheimer, è tipicamente basata sulle progressive debilitazioni cognitive, avendo escluso altre malattie. Tuttavia, la diagnosi clinica è spesso difficile nei casi con sintomi lievi e non specifici che possono essere attribuiti a patologie diverse e sovrapposte, in quanto si presentano come fenotipi simili. Di conseguenza, la diagnosi definitiva delle malattie neurodegenerative è ancora affidata alle pratiche post-mortem. All’esame autoptico il cervello del malato di Alzheimer è caratterizzato da una grave atrofia corticale e microscopicamente dalla presenza di placche extracellulari β-amiloidi e di grovigli neurofibrillari intracellulari. Si sono ottenuti, soprattutto recentemente, grandi progressi nello sviluppo dei traccianti d’imaging PET per il rilevamento non invasivo della β-amiloide. In tale contesto, le recenti comunicazioni scientifiche definiscono il Pittsburgh Compound B (PIB), come il migliore mezzo di successo per meglio caratterizzare e legarsi preferenzialmente alla β-amiloide fibrillare delle placche e con affinità molto inferiore alle forme oligomeriche di quella specie di β-amiloide ritenuta tossica nella malattia di Alzheimer. Pur tuttavia, da una parte gli studi PET d’imaging hanno confermato che la deposizione di βA si verifica ben prima della comparsa dei sintomi, supportando l'ipotesi che questo dato rappresenta la malattia preclinica di Alzheimer. Dall’altra parte è mancata la dimostrazione di una correlazione tra deposizione della βA nella placca con il decadimento cognitivo della malattia di Alzheimer, suggerendo che i marcatori per i diversi effetti e a valle della stessa βA potrebbero essere più adatti per valutare la progressione della malattia. Di conseguenza, si è maturata la necessità di nuovi ligandi per l’indagine alternativa di biomarcatori, come indicatori specifici della neurodegenerazione. Tali agenti possono, di certo, rivelarsi preziosi per la diagnosi, il follow-up e il monitoraggio terapeutico della malattia di Alzheimer e delle altre demenze. Un biomarker evidente è la tau, una MAP (microtubulo-associated-protein), particolarmente abbondante nei neuroni, e più particolarmente i suoi depositi anomali iperfosforilati, come i grovigli neurofibrillari, i fili neuropili e i neuriti distrofici circostanti le placche della βA, una caratteristica patologica della malattia di Alzheimer. Tuttavia, i depositi tau sono anche una caratteristica di un più ampio gruppo di malattie neurodegenerative, denominate taupatie, tra cui la sporadica degenerazione corticobasale, la paralisi sopranucleare progressiva, la malattia di Pick, ma anche la demenza fronto-temporale e il parkinsonismo legato al cromosoma 17 (FTDP-17). A differenza della deposizione della βA nella placca, studi post-mortem nell’uomo indicano che la densità del groviglio neurofibrillare correla con la neurodegenerazione e il deterioramento cognitivo. Inoltre, nei soggetti, non deteriorati cognitivamente, non si osservano abbondanti grovigli neurofibrillari, in contrasto con le placche di βA presenti in alcune persone non-dementi. Peraltro, la CSF-tau e la fosfo-tau (ptau181) si sono rivelate utili biomarcatori per la diagnosi della malattia di Alzheimer. Nonostante che la valutazione quantitativa dei livelli liquorali di tau e fosfo-tau possano essere biomarcatori affidabili della neurodegenerazione, la puntura lombare, però, rappresenta una procedura invasiva per lo screening diffuso della popolazione a rischio. Inoltre, le misure sul CSF non forniscono informazioni sulla deposizione regionale tau del cervello che possono avere una chiara correlazione con la cognizione, cioè l'ippocampo. Pertanto, questi elementi potrebbero non essere in grado di fornire informazioni importanti sui risultati finalizzati attualmente in terapia in risposta ai farmaci. La neuroimaging molecolare con traccianti tau-specifici può fornire, in effetti, elementi estremamente precisi, affidabili, riproducibili e quantitativi del tau cerebrale globale e regionale, essenziali per la valutazione della progressione della malattia, il reclutamento sperimentale terapeutico e la valutazione delle terapie tau-specifiche, sia per l'Alzheimer sia per le taupatie non Alzheimer, in cui la tau gioca un ruolo centrale. Certo, la sostenibilità d’immagini con tratti specifici della malattia è stata dimostrata negli ultimi anni dai ligandi PET come la 11C-PiB e 18F-FDDNP, utilizzati per l'imaging di deposizione della βA. A differenza del PiB, è stato suggerito che lo FDDNP si lega anche ai grovigli neurofibrillari che possono contribuire alla ritenzione di 18F-FDDNP nella corteccia temporale mesiale dove i traccianti specifici della βA, quali lo 11C-PiB, poco si legano. Si sono anche individuati nuovi derivati del benzimidazolo e della chinolina che legano i grovigli neurofibrillari e, in misura minore, la βA nelle placche. Le analisi seriali di questi composti hanno portato alla progettazione e alla sintesi di un agente d’imaging nuovo, lo 18F-THK523.
Christopher Rowe dell’Austin Hospital, Victoria - Australia e collaboratori hanno effettuato scansioni cerebrali con PET allo 11C-PiB su 366 partecipanti anziani, 195 sani di controllo, novantadue con DCL e settantanove con malattia lieve di Alzheimer, di età media di settantadue anni al basale, a venti mesi e dopo trentasei mesi (J Nucl Med. 2011; 52 (Supplement 1):121). I risultati hanno mostrato la deposizione di βA in molti dei pazienti sani di controllo. Pur tuttavia, quelli con la deposizione maggiore nella placca mostravano una maggiore probabilità di sviluppare i disturbi cognitivi, rispetto a quelli con deposizione minore. I casi di DCL, che non avevano la deposizione di βA al basale, presentavano minori probabilità nel tempo di sviluppare ulteriore declino cognitivo. Le scansioni mostravano volumi di base dell'ippocampo significativamente più bassi tra i partecipanti con malattia di Alzheimer e quelli con DCL. Deposizioni alte di βA, indicate dalle scansioni positive PiB, si osservavano nel 98% dei pazienti con MA, nel 63% di quelli affetti da DCL e nel 34%, dato interessante, dei pazienti sani di controllo. Tali dati portavano gli autori a concludere che in caso di sani ma βA-positivi alla 11C-PiB PET dopo due anni di follow-up si sarebbe in grado di dimostrare una maggiore perdita di materia grigia nelle aree tipiche degli affetti da malattia di Alzheimer e il declino della memoria lieve progredirebbe più rapidamente. Sempre secondo gli autori, la βA si proporrebbe, quindi, come forte predittivo dell’avanzamento del declino cognitivo, per cui il 54% dei pazienti con DCL con 11C-PiB PET-positiva progredirebbe verso la MA, rispetto al solo 14% dei pazienti con DCL PiB-negativi e al 13% dei DCL PIB-negativi che progredirebbero verso altre forme di demenza. Comunque, a tre anni di follow-up tra i pazienti sani di controllo il 10% dei PiB positivi sviluppavano il DCL e il 5% la MA, mentre solo il 2% dei PiB negativi sviluppavano il DCL. I risultati, in effetti, dimostrerebbero la natura non benigna della deposizione di βA nel cervello, essendosi rilevata una percentuale superiore al 98% (IC 95%, 93-99%), di possibilità che un anziano asintomatico PiB- negativo di controllo cognitivamente sano potesse rimanere stabile nel triennio futuro, in contrasto al 15% di rischio di sviluppare malattia di Alzheimer o DCL, se PIB positivo. Inoltre, i portatori dell'allele E e4 dell'apolipoproteina E, considerato un fattore di rischio per la MA e la demenza vascolare, dimostravano anche un rischio per il declino cognitivo significativamente più alto da due a tre volte.
Sottotipi del decadimento cognitivo lieve
Il decadimento cognitivo lieve (DCL) è, in effetti, uno stato intermedio tra lo stato cognitivo normale dell’invecchiamento e la demenza. È, quindi, una sindrome con una o più cause e con una grande possibilità di progredire verso la demenza vera e propria secondo le caratteristiche individuali e comportamentali dell’individuo e in rapporto anche alle condizioni dell'ambiente. Oggi, una volta abbandonato il criterio che la definiva una fase iniziale della malattia di Alzheimer, dopo l'introduzione dei criteri di Petersen, è considerata una sindrome che include la prova oggettiva e soggettiva di perdita di memoria, nel contesto di un sostanzialmente normale stato mentale, senza perdita dell’indipendenza funzionale. Dal momento della sua individuazione gli studiosi si sono posti l'obiettivo della sua tipizzazione per una descrizione omogenea che rispondesse alle necessità eziologiche e prognostiche, con identificazioni di sottotipi per un suo diverso aspetto e un differenziale comportamento del malato.
Comunque, il DCL, per come attualmente definito, rimane clinicamente e prognosticamente eterogeneo e con l’impegno scientifico di poterlo suddividere nel futuro in sottogruppi per scopi diversi con l’uso possibile dei biomarker. La sottotipizzazione del DCL, in base al tipo e al numero delle prestazioni compromesse, sarebbe, di certo, utile per identificare lo stadio della malattia in relazione ai diversi biomarcatori o per selezionare gli interventi più appropriati per un dato paziente. La sottotipizzazione, di poi, secondo la presenza di un biomarker o di un genotipo potrebbe, di certo, determinare e migliorare il valore predittivo e la risposta alla modalità di uno specifico trattamento. In occasione di sufficienti dati prospettici, i risultati osservati potrebbero, inoltre, consentire l’individuazione dei profili dei sottotipi che fanno o non progredire verso la demenza.
Il gruppo di lavoro internazionale IWG con Winblad B del Karolinska Institutet, - Stockholm ha, peraltro, distinto il DCL in sottotipi (J Intern Med. 2004 Sep;256(3):240-6) come segue:
• amnesico, come singolo dominio cognitivo,
• più domini cognitivi, di cui uno è la memoria,
• un dominio singolo, esclusa la memoria,
• domini cognitivi multipli, esclusa la memoria.
Perminder S. Sachdev dell’University of New South Wales, Sydney e collaboratori, per confrontare i profili del rischio dei sottotipi del DCL, hanno svolto uno studio trasversale su di un campione di 657 anziani senza demenza dai settanta ai novanta anni, arruolati nel Sydney Memory and Ageing Study.

Hanno, quindi, seguito una vasta valutazione neuropsicologica per diagnosticare il DCL e i suoi sottotipi, classificati come amnesico (aMCI) o non amnesico (naMCI), sia come dominio singolo (sdMCI) sia multiplo (mdMCI) (Am Geriatr Soc. 2012;60(1):24-33). I profili del rischio erano ricavati dalle caratteristiche socio demografiche, dallo stile di vita, dalle condizioni cardiocircolatorie, fisiche, mentali e di salute generale.
I fattori di rischio per il DCL erano la presenza dell’allele dell’apolipoproteina E (APOE) e4, delle malattie cardiache, dell’alta omocisteina, della scarsa capacità d’identificazione degli odori, della bassa acutezza visiva e della limitata attività mentale.
Le probabilità di avere la naMCI piuttosto che l’aMCI erano inferiori in rapporto con i maggiori livelli di attività sociale. Erano più alte, invece, se si assumevano farmaci antipertensivi, in particolare negli uomini. Peraltro, le probabilità di naMCI erano maggiori negli uomini che assumevano antidepressivi o con un test del cammino più lungo, ma anche nelle donne con ipertensione.
La probabilità di avere mdMCI piuttosto che sdMCI erano maggiori nei partecipanti con una storia di depressione o che avevano l’allele APOE e4. Maggiori probabilità di mdMCI erano anche associate alla minore attività mentale, in particolare per le donne. Per gli uomini, le probabilità di mdMCI erano maggiori con l’APOE e4, mentre inferiori in caso di diagnosi di colesterolo alto. In conclusione, i sottotipi del DCL avrebbero presentato, secondo questo studio, caratteristiche distintive di rischio dipendenti dal sesso. Tutto ciò concorderebbe con il fatto che i sottotipi del DCL avrebbero eziologie e risultati diversi, supportando l'ipotesi che la tipizzazione potrebbe offrire un valore predittivo e un’applicazione clinica.
Il declino cognitivo lieve è più frequente negli uomini o nelle donne?
R.C. Petersen della Mayo Clinic, Rochester, MN e collaboratori hanno, per loro conto, valutato la prevalenza del deterioramento cognitivo lieve (DCL) in un campione casuale di residenti della contea di Olmsted (MN) di età dai settanta agli ottantanove anni il 1° ottobre 2004 (Neurology September 7, 2010 vol. 75 no. 10 889-897). È stata utilizzata la Clinical Dementia Rating Scale per la valutazione neurologica e i test neuropsicologici di 4 domini cognitivi: memoria, funzione esecutiva, linguaggio e abilità visuospaziale. Dei 1.969 soggetti senza demenza 329 avevano il DCL, con una prevalenza del 16,0% (intervallo di confidenza al 95% [IC] 14,4-17,5) per qualsiasi tipo, 11,1% (CI 95% : 9,8-12,3) per la forma amnesica e 4,9% (IC 95% : 4,0-5,8) per la non amnesica. La prevalenza del DCL aumentava con l'età e risultava più alta negli uomini. L’OR (odds ratio) di prevalenza negli uomini era 1,54 (IC 95% 1,21-1,96; aggiustato per età, istruzione e la non partecipazione). La prevalenza era più alta in chi non era mai stato sposato, nel caso del genotipo APOE ε3ε4 o ε4ε4, mentre diminuiva con il numero crescente degli anni d’istruzione (p per trend lineare <0,0001), suggerendo che circa il 16% dei soggetti anziani privi di demenza sarebbe stato affetto da DCL, con la forma amnesica come tipo più comune. La più alta prevalenza di DCL negli uomini avrebbe suggerito, invece, che nelle donne la transizione in età avanzata da una cognizione normale direttamente alla demenza sarebbe avvenuta più bruscamente.
Da notare, comunque, che nei settantenni la prevalenza del DCL viene stimata tra il quattordici e il 18% e il tasso di progressione verso la demenza è considerato considerevolmente maggiore rispetto all’1-6% l'anno per le persone senza il disturbo e pari al 4,2% (intervallo di confidenza 95% (IC) = 3,9-4,6%) nella popolazione generale e al 10-15% nei soggetti ad alto rischio. Tuttavia, il DCL si dimostra ancor oggi una sindrome clinica complessa e le evidenze più recenti hanno suggerito la sua non obbligata progressione verso la demenza conclamata, essendo possibili nel tempo anche miglioramenti clinici.
In seguito R.O. Roberts della Mayo Clinic, Rochester, MN e collaboratori, per convalidare il dato di differenza di genere sulla prevalenza del DCL, hanno compiuto un altro studio prospettico di coorte sempre basato sui residenti della Olmsted County, MN, di età dai settanta agli ottantanove anni (Neurology WNL.0b013e3182452862; January 25, 2012). Tra i 1.450 soggetti cognitivamente normali al basale 296 sviluppavano DCL con tasso d’incidenza standardizzato per età e sesso del 63,6 per 1.000 anni-persona, 72,4 negli uomini e 57,3 nelle donne, 37,7 per il sottotipo aMCI e 14,7 in quello naMCI. Il tasso d’incidenza del tipo aMCI era, peraltro, 43,9 negli uomini e 33,3 nelle donne e 42,6 per i soggetti con anni d’istruzione eguali o inferiori a 12 e 32,5 per quelli con istruzione superiore. Il rischio del sottotipo naMCI era anche maggiore per gli uomini con 20,0, rispetto alle donne con 10,9 e per i soggetti con anni d’istruzione eguali o inferiori a dodici con 20,3, rispetto a quelli con istruzione superiore con 10.2. Gli autori concludevano, quindi, che i tassi d’incidenza del DCL erano sostanziali e le differenze dei sottotipi clinici e per sesso suggerivano di dover esaminare separatamente i fattori di rischio per l’aMCI e la naMCI, ma anche negli uomini e nelle donne.
Yaffe K dell’University of California at San Francisco e collaboratori, considerando non ben quantificata la prevalenza del deterioramento cognitivo non è ben qualificato nei molto anziani hanno svolto uno studio di coorte prospettico su un totale di 1.299 grandi vecchie donne di età media di 88,2 anni con il 27,0% di novanta o più, arruolate nel Cognitive Impairment Women Study of Exceptional Aging, studio relativo alle fratture osteoporotiche (Arch Neurol. 2011 May;68(5):631-6). Nel 17,8%, corrispondente a 231 donne veniva diagnosticata la demenza e nel 23,2%, 301 soggetti, il DCL per una prevalenza di compromissione combinata cognitiva del 41,0%. La diagnosi clinica di MA e quella di demenza mista erano le più comuni, ciascuna dei quali per 40% dei casi. Nel campo del DCL i tipi più comuni erano, invece, l’amnesico con più domini e il non amnesico con singolo dominio, pari al 33,9% e 28,9% dei casi rispettivamente. Inoltre, il deficit cognitivo era più frequente nelle donne di novanta anni o più, rispetto a quelle dagli ottantacinque agli ottantanove anni (demenza, 28,2% vs 13,9%, P <.001; MCI, 24,5% vs 22,7%, P = 0,02) ed era più comune nelle donne con istruzione inferiore, una storia d’ictus e una depressione prevalente. I risultati portavano gli autori a concludere che nel loro ampio campione di studio di donne più del 41,0% era stato passibile di giudizio clinico di deterioramento cognitivo e che i sottotipi di demenza e di DCL erano simili a quelli delle popolazioni più giovani. Rispetto alle donne con cognizione normale, le dementi erano in media più anziane, con minore probabilità di avere ultimato la scuola superiore e con maggiore probabilità di vivere confinate in una casa di cura. Inoltre le donne dementi presentavano anche maggiore probabilità di depressione, di storia d’ictus e di avere uno degli alleli dell’apolipoproteina E ε4 (APOE ε4).
Natura del deficit di memoria del declino cognitivo lieve
Villeneuve S dell’Université de Montréal e collaboratori hanno misurato il deficit della memoria episodica nei soggetti con decadimento cognitivo lieve (DCL) in funzione del valore della compromissione vascolare (Neuropsychologia. 2011 Sep;49(11):3027-35). Quest’ultima era determinata da una parte clinicamente, calcolando il numero di fattori di rischio e delle malattie vascolari e dall’altra neuro radiologicamente, valutando la presenza e la gravità delle lesioni della materia bianca (WML). I processi di memoria strategici erano misurati con rievocazione libera e compiti temporali di memoria di contesto che richiedevano il recupero autonomo. I risultati dimostravano nei casi di DCL con elevato carico vascolare una compromissione dei processi di memoria strategici, mentre in quelli senza onere vascolare sia di quelli strategici sia no. Un modello simile si reperiva utilizzando un indice sia clinico del profilo di rischio vascolare sia neuroradiologico, valutando l'entità e la gravità delle WML sottocorticali. Tuttavia, l'effetto delle WML sulla memoria differiva in funzione del livello d’istruzione, qui utilizzato come proxy per la riserva cognitiva. Tra i partecipanti con DCL coloro con istruzione superiore e non con le WML avevano la minore compromissione della memoria. Lo studio esaminava anche la memoria in funzione del fatto che i pazienti in seguito potessero progredire verso la demenza dopo tre anni di follow-up. Nell’esame delle prestazioni di chi progrediva, i processi strategici e non strategici erano entrambi compromessi in quelli senza condizioni concomitanti vascolari, mentre in quelli con un elevato carico vascolare si dimostrava minore compromissione dei non strategici rispetto agli strategici. Complessivamente, i risultati indicavano che la presenza del carico vascolare nel DCL si associava ad alterazioni selettive dei processi di memoria strategica.
Villeneuve S e Belleville S. dell’Université de Montréal - Quebec hanno anche esaminato in seguito se nel DCL l'atrofia ippocampale e il fattore vascolare potessero costituire condizioni differenziali relative alle diverse capacità di memoria. Hanno, inoltre, valutato se le prestazioni della memoria e le alterazioni cerebrali differissero in funzione dello sviluppo successivo, o meno, della demenza e se potessero predire la progressione verso la demenza (Neurobiol Aging. 2011 Nov 14). Lo studio includeva settantasette partecipanti, di cui quarantanove rispondevano ai criteri del DCL e ventotto erano adulti sani. I risultati dimostravano deficit di legame di memoria e una maggiore vulnerabilità alle interferenze proattive nei soggetti con DCL, rispetto agli adulti sani più anziani. Il volume dell'ippocampo correlava con le capacità di legame, mentre nelle persone con DCL le incombenze vascolari erano associate con la resistenza alle interferenze. Le analisi al follow-up indicavano che il deficit di legame prediceva la progressione da DCL alla demenza. In conclusione, i deficit di legame e la vulnerabilità alle interferenze proattive erano presenti nei casi di DCL ed erano associati a marcatori cerebrali diversi. Tuttavia, solo i deficit di legame predicevano la progressione verso la demenza.
La riserva cognitiva ne influenza il declino?
Archana Singh-Manoux del Paul Brousse Hospital, Villejuif, France e collaboratori, sulla base che la riserva cognitiva si associa a un minor rischio di demenza e considerando poco chiara la misura con cui nell’invecchiamento si delinea il possibile decadimento cognitivo, hanno voluto esaminare da diversi punti l'impatto di tre marker di riserva sulla funzione cognitiva e sul suo declino nella tarda età adulta (Annals of Neurology Volume 70, Issue 2, pages 296–304, August 2011). Hanno, quindi, arruolato dal Whitehall II cohort study 5.234 uomini e 2.220 donne di età media di cinquantasei anni (deviazione standard = 6) al basale. Hanno valutato tre volte per più di dieci anni la memoria, il ragionamento, il vocabolario, la fluidità fonetica e semantica. Hanno utilizzato modelli misti lineari per valutare l'associazione tra i marcatori di riserva (altezza, istruzione e professione) e il declino cognitivo, utilizzando i cinque test cognitivi e di un punteggio cognitivo globale, composto di questi stessi test. Tutte le tre misure di riserva si associavano con la funzione cognitiva di base, essendo più forti con l'occupazione e più deboli con l'altezza. Tutte le funzioni cognitive, tranne il vocabolario, diminuivano nel corso dei dieci anni di follow-up. Nella prova cognitiva globale non vi era una maggiore diminuzione nel gruppo ad alta occupazione (-0,27; intervallo di confidenza al 95% [IC], da -0,28 a -0,26), rispetto al gruppo intermedio (-0,23, 95% IC, -0,25 a -0,22 ) e a quello basso (-0,21, 95% IC, -0,24 a -0,19), p = 0,001. Il declino nei gruppi di riserva, definiti attraverso l'istruzione (p = 0,82) e l'altezza (p = 0,55), era simile. In conclusione, nel corso della vita adulta la performance cognitiva era notevolmente più alta nei gruppi con elevata riserva. Tuttavia, il tasso di declino cognitivo non risultava diverso tra i gruppi di riserva con l'eccezione dell’occupazione, dove nei casi di alta entità c'era qualche evidenza di essere maggiore.
Sul tempo d’insorgenza del declino cognitivo
In seguito, Archana Singh-Manoux dell’Istituto INSERM France e collaboratori, proprio per stimare il declino della funzione cognitiva, hanno eseguito uno studio prospettico arruolando dalla coorte Whitehall II 5.198 uomini e 2.192 donne di età compresa tra i quarantacinque e i settanta anni all'inizio dei test cognitivi (BMJ 2012;344:d7622).
Nell'arco di dieci anni per tre volte si sono valutati i principali risultati dei test di misura della memoria, del ragionamento, del vocabolario, della scioltezza della fonetica e della semantica. Tutti i punteggi cognitivi, ad eccezione del vocabolario, degradavano in tutte e cinque le categorie di età dai quarantacinque ai quarantanove, dai cinquanta ai cinquantaquattro, dai cinquantacinque ai cinquantanove, dai sessanta ai sessantaquattro e dai sessantacinque ai settanta anni, con evidenza di un più rapido declino nelle persone più anziane.
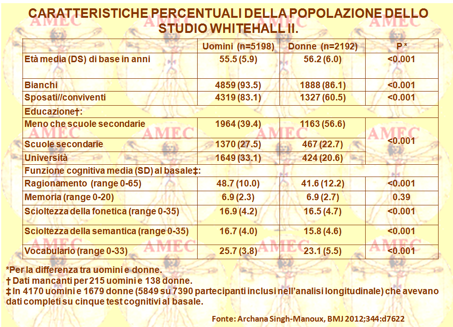
Negli uomini dai quarantacinque ai quarantanove anni al basale il declino nei dieci anni nel ragionamento, indicato come il cambiamento / range di test × 100, era -3,6% (95% intervallo di -4,1% al -3,0%) e in quelli dai sessantacinque ai settanta di età -9,6% (-10,6% al -8,6%). Nelle donne il calo era rispettivamente pari a -3,6% (-4,6% a -2,7%) e a -7,4% (-9,1% a -5,7%). Il confronto degli effetti sezionali longitudinali e trasversali di età suggeriva che il declino era sovrastimato nelle donne nell’ultimo caso a causa delle differenze di coorte in materia d’istruzione. Per esempio, nelle donne di età dai quarantacinque ai quarantanove anni l'analisi longitudinale mostrava un ragionamento diminuito del -3,6% (-4,5% a -2,8%), ma gli effetti trasversali suggerivano un calo del -11,4% (-14,0% a -8,9%). In conclusione, comunque, lo studio dimostrava che il declino cognitivo era già evidente nella mezza età dai quarantacinque ai quarantanove anni.
Dedifferenziazione terminale delle abilità cognitive
R.S. Wilson della Rush University Medical Center - Chicago e collaboratori, dal loro canto, per verificare l'ipotesi della dedifferenziazione cognitiva, secondo cui le abilità intellettive diventano sempre più correlate in tarda età (Neurology April 10, 2012 78:1116-1122), hanno arruolato 174 anziani tra suore, preti e monaci cattolici partecipanti al Religious Orders Study, senza demenza all'inizio di uno studio clinico-patologico longitudinale di coorte. A intervalli annuali per 6 - 15 anni prima della morte, i partecipanti hanno completato una batteria di test di performance cognitive con misure composite di memoria episodica, memoria semantica, memoria di lavoro e velocità percettiva. Al momento della morte, ci sono state una valutazione uniforme neuropatologica e una valutazione dei livelli di placche diffuse e neuritiche e dei grovigli neurofibrillari. Mediamente il declino cognitivo prima del periodo terminale era relativamente graduale e i tassi di variazione nei diversi domini cognitivi erano moderatamente correlati da 0,25 per la memoria episodica e del lavoro a 0,46 per quell’episodica e semantica. Al contrario, la cognizione declinava rapidamente durante il periodo terminale e i tassi di variazione delle diverse funzioni cognitive erano fortemente correlati da 0,83 nella memoria di lavoro e velocità percettiva a 0,89 nella memoria episodica, semantica e di lavoro. Il più alto livello di placche e grovigli all’esame post-mortem era associato con il declino più rapido preterminale e con la precoce insorgenza dello stesso, ma non con il suo tasso o con le correlazioni tra i tassi di variazione nelle diverse funzioni cognitive.
Secondo Wilson i risultati avrebbero suggerito, pertanto, che nuovi fattori dovessero entrare in gioco per causare una tale perdita precipitosa delle funzioni cognitive ed anche per cancellare le distinzioni tra le diverse capacità cognitive. Lo studio avrebbe fornito, inoltre, prove sostanziali a sostegno dell’ipotesi che le capacità cognitive diventano sempre più correlate o dedifferenziate in età avanzata.
Sulla progressione del decadimento cognitivo lieve
Il concetto di riserva cognitiva ha interessato per anni gli studiosi nel campo della ricerca della demenza. A tale proposito si è da tempo pensato che gli elevati livelli d’istruzione e / o uno stile di vita attivo, soprattutto mentale, possano rendere l’individuo meno suscettibile al decadimento cognitivo, aumentando la riserva funzionale del cervello. La comprensione dei possibili meccanismi che si attuano in tal modo rappresenta un campo di grande interesse e importanza per gli eventuali trattamenti preventivi.
Hedden T, Gabrieli JD della Stanford University in una loro analisi concludevano, peraltro, che, pur essendoci un emergente consenso che anche gli adulti di età inferiore ai sessanta anni potessero verificare un relativo declino cognitivo, si riscontrava in letteratura scarsa evidenza a tale riguardo (Nat Rev Neurosci. 2004 Feb;5(2):87-96).
A J Mitchell dell’University of Leicester e M Shiri-Feshki, del Nottinghamshire Healthcare NHS Trust, Nottingham – UK hanno esaminato nella letteratura quindici studi a lungo termine con particolare attenzione all’ACR (annual conversion rate) del DCL in demenza, confrontandoli con i risultati degli studi che utilizzano più brevi periodi di osservazione (J Neurol Neurosurg Psychiatry 2008;79:1386-1391). In tutti i trial di coorte, in cui era completato il follow-up, la media dell’ACR verso la demenza era del 4,2% (95% IC 3,9% al 4,6%). Tale dato era inferiore al tasso riportato dagli studi di durata inferiore ai cinque anni. La percentuale di conversione a demenza e alla malattia di Alzheimer diminuiva con i periodi di osservazione più lunghi, suggerendo che il rischio di progressione diminuirebbe con il tempo. In conclusione, un tasso di ACR del 10-15% apparirebbe solo in campioni clinici controllati nel corso di un periodo di osservazione breve. L’assunzione di persone anziane provenienti dai centri specialistici che, in particolare, coinvolgono coloro che si lamentano delle difficoltà cognitive, come i disturbi di memoria soggettivi, tenderebbe, invero, a fornire tassi di conversione elevati. Nei primi anni di follow-up, difatti, molti di quelli con il profilo di rischio più avverso tenderebbero alla progressione, ma anche all’abbandono o alla morte, lasciando una coorte di malati meno vulnerabili. Tuttavia, una relazione inversa temporale si manifestava anche in chi aveva completato il follow-up a lungo termine, suggerendo il coinvolgimento di altri fattori, come questioni di campionamento o eterogeneità del DCL stesso.
Ritchie LJ e Tuokko H dell’University of Manitoba, Winnipeg, Canada, con l’obiettivo di confrontare la capacità predittiva dei diversi modelli di decadimento cognitivo lieve (DCL), come marker di demenza incipiente in un campione longitudinale della popolazione canadese, hanno esaminato l'uso dei criteri esistenti e ben documentati di definizione del DCL utilizzando i dati del CSHA (Canadian Study of Health and Aging). Hanno, così, calcolato le caratteristiche demografiche, la media dei risultati dei test neuropsicologici e le frequenze di campionamento e i tassi di conversione per ogni classificazione. Hanno impiegato le analisi ROC (Receiver operating characteristic) per valutare il potere predittivo di ogni classificazione cognitiva. Le frequenze di campionamento più alte e i tassi di conversione si associavano con le definizioni di più domini di DCL. Gli unici criteri diagnostici per predire in modo significativo la demenza cinque anni più tardi erano la definizione CIND -2 (cognitive impairment no dementia). Le definizioni dei casi di DCL più restrittive non riuscivano ad affrontare gli aumenti variabili temporali del declino in tutti i diversi domini cognitivi nella progressione dal normale funzionamento cognitivo alla demenza (Am J Alzheimers Dis Other Demen. 2010 Nov;25(7):592-603. Epub 2010 Sep 21).
Mary Ganguli dell’University of Pittsburgh e collaboratori, per verificare i risultati del DCL in rapporto alle sue diverse definizioni, hanno eseguito uno studio di coorte con un anno di follow-up su 1.982 individui di sessantacinque anni e oltre. (Neurol 2011;68:761–767). I partecipanti erano classificati come affetti da DCL, secondo i criteri Mayo mnesici, quelli dell’International Working Group, quelli del CDR (Clinical Dementia Rating) = 0.5, e secondo una classificazione puramente cognitiva in amnesica e non amnesica. Per ogni definizione del DCL si evidenziavano tre possibili risultati:
1. il peggioramento con progressione verso la demenza [CDR 1] o verso la grave compromissione cognitiva,
2. il miglioramento con ritorno a un CDR = 0, o alla cognizione normale,
3. la stabilità con CDR o stato cognitivo invariato.
Dopo oltre un anno, indipendentemente dalla sua definizione, una piccola percentuale di partecipanti progrediva fino a CDR> 1 (range, 0% -3%) o grave deficit cognitivo (0% -20%) a tassi più elevati rispetto ai coetanei cognitivamente normali. Una proporzione un po' più grande migliorava o tornava alla normalità (6% -53%), mentre la maggior parte rimaneva stabile (29% -92%). Con le definizioni focalizzate sui disturbi della memoria e su più domini cognitivi, proporzioni maggiori di soggetti progredivano verso la malattia, mentre un numero minore migliorava il CDR. Lo studio, secondo gli Autori, avrebbe teso a confermare l’eterogeneità del DCL e che esso negli anziani progredirebbe verso la demenza a tassi superiori al normale. Peraltro, i deficit di memoria e le menomazioni in più domini tenderebbero verso una maggiore progressione di malattia e un minore tasso di miglioramento.
John C. Morris della Washington University, per valutare l'impatto potenziale dei nuovi criteri riguardanti il deterioramento cognitivo lieve (DCL) sviluppati da un gruppo di lavoro sponsorizzato dal National Institute on Aging e dall’associazione di Alzheimer sulla diagnosi dell’Alzheimer (MD) molto mite e mite, ha progettato una revisione retrospettiva di valutazioni del danno funzionale tra le categorie diagnostiche (Arch Neurol. February 6, 2012. doi:10.1001). L’Autore ha considerato 17.535 soggetti con funzioni cognitive normali, con DCL, con MA o demenza di altro tipo. Le valutazioni funzionali degli individui normali, con DCL o con demenza MA, eseguite presso gli Alzheimer's Disease Centers e presentate al National Alzheimer's Coordinating Center, sono state ottenute in conformità con la definizione d’indipendenza funzionale, consentita dai criteri rivisitati. Quasi la totalità, il 99,8% delle persone con diagnosi attuale di demenza MA molto mite, e la grande maggioranza, il 92,7% di quelle con diagnosi di demenza MA lieve, sarebbero potute essere riclassificate come aventi DCL con i nuovi criteri in base al livello delle compromissioni nella valutazione pratica clinica dei domini di demenza per lo svolgimento delle attività strumentali della vita quotidiana nella comunità e a casa. Una percentuale rilevante di questi individui con demenza MA rispondeva anche alla versione riveduta del criterio d’indipendenza funzionale del DCL, come misurata attraverso il questionario di valutazione funzionale. In conclusione, la distinzione categorica tra DCL e le fasi più lievi di demenza della MA è stata intaccata dai nuovi criteri. La sovrapposizione risultante diagnostica supporta la premessa che il DCL, dovuto alla MA, rappresenta la prima fase sintomatica della stessa MA.
Hiroko H dell’Oregon Health & Science University e collaboratori nel loro editoriale hanno ribadito la non chiara relazione tra il terminale del declino cognitivo e una sottostante latente MA o altra malattia non sufficientemente grave da varcare la soglia clinica o se lo stesso potesse essere attribuibile a processi biologici presumibilmente legati alla mortalità imminente (Neurology April 10, 2012 vol. 78 no. 15 1110-1111).

