Eccesso di peso e cancro
L'obesità gioca un ruolo d’induzione, sia in termini di rischio sia di mortalità, per diverse grandi malattie, tra cui quelle cardiovascolari e il diabete. In particolare, numerosi studi epidemiologici hanno ormai costantemente dimostrato che essa si associa anche a un aumentato rischio di molti tumori.
L'obesità può, inoltre, interferire con l’efficacia della terapia sistemica del cancro e può contribuire alla morbilità nel corso del suo trattamento.
È anche un fattore di rischio per la scarsa guarigione delle ferite post-operatorie, per le infezioni, per il linfedema e per lo sviluppo di comorbilità, come le malattie cardiache, quelle cerebrovascolari e il diabete. Peraltro, gli obesi che sopravvivono al cancro presentano un aumentato rischio di sviluppare una seconda neoplasia maligna.
In ultima analisi, il rapporto tra l’obesità e le comorbilità dimostrerebbe, dopo la diagnosi del cancro, un grande impatto sugli anni di sopravvivenza globale, come anche sulla potenziale correlazione con la recidiva della malattia.
Per altro verso, diversi studi hanno dimostrato che, sia durante sia dopo il trattamento del cancro, aumentando l’attività fisica e migliorando la qualità alimentare con la riduzione dell'apporto calorico nella dieta, si ottiene una serie di vantaggi, tra cui la migliore qualità della vita, la minore faticabilità, la migliore immagine del corpo, la minore incidenza di comorbidità.
Purtroppo, la prevalenza globale dell’obesità, sia negli adulti e sia in età pediatrica, è in continua crescita e dal 1980 è quasi raddoppiata. Parallelamente a questa tendenza, bisogna aspettarsi certamente un aumento anche del cancro e, in particolare, nell’America meridionale e nell’Africa settentrionale dove ormai si registrano i maggiori aumenti del tasso dell’eccesso di peso degli ultimi trenta anni.
I rilievi epidemiologici sul cancro continuano, peraltro, a sollevare serie preoccupazioni. La diagnosi annuale della malattia supera, difatti, i dodici milioni di casi con una mortalità che interessa ben 7,6 milioni di persone. In mancanza d’iniziative concrete l’UICC (Union for International Cancer Control) ha indicato 26.000.000 di nuovi casi e 17.000.000 di morti per tumori maligni entro il 2030, soprattutto nei Paesi in via di sviluppo. Pur tuttavia, per quanto riguarda l’Italia, i decessi per cancro sono stimati in netto calo. Difatti, nel periodo dal 1996 al 2014 sono diminuiti negli uomini del 18% e del 10% nelle donne. Peraltro, i nuovi casi sono sostanzialmente invariati e stimati 360.000 nel 2011, 364.000 nel 2012, 366.000 nel 2013 e 365.500 nel 2014, di cui 196.100 (il 54%) negli uomini e 169.400 (il 46%) nelle donne. L’AIOM (Associazione Italiana di Oncologia Medica), anche per ribadire che la prevenzione costituisce lo strumento più efficace per combattere il cancro, ha aderito alla Giornata Mondiale contro il Cancro promossa dall’UICC, organizzazione non governativa che rappresenta le associazioni impegnate nella lotta alla malattia in oltre 100 Paesi. L’edizione 2015, sostenuta anche dall’Organizzazione Mondiale della Sanità, ha focalizzato il tema “Combattere il tumore con la Prevenzione”. L’AIOM, prefiggendosi concordemente una strategia che potesse coinvolgere oncologi, pazienti, istituzioni, associazioni e media, ha promosso il progetto “Diamoci un dieci per sconfiggere il cancro”.
Carmine Pinto, Presidente dell’AIOM ha, quindi ripresentato le dieci semplici regole quotidiane di prevenzione:
- Abolire il fumo.
- Ridurre il grasso corporeo mantenendo un IMC (indice di massa corporea) tra ventuno e ventitré.
- Fare attività fisica moderata, come il camminare velocemente almeno per mezz’ora il giorno.
- Limitare i cibi ipercalorici ed evitare le bevande zuccherate.
- Ridurre le carni rosse a un massimo di 500 g/settimana, evitando gli insaccati.
- Limitare il consumo di alcool a un massimo di due bicchieri di vino o di birra il dì.
- Consumare almeno cinque porzioni il dì di frutta e verdura.
- Evitare l’eccessiva esposizione al sole.
- Consultare tempestivamente il medico in caso di sospetto, come per un nodulo al seno, un’ulcerazione cutanea che non si rimargina, un neo che cambia forma o colore, del sangue nelle feci, una perdita di peso.
- Partecipare ai programmi di screening (per le donne sopra i venticinque anni per il carcinoma della cervice, per le donne e gli uomini sopra i cinquanta anni per il carcinoma del colon, per le donne sopra i cinquanta anni per il carcinoma della mammella).
I meccanismi biologici di maggior studio sono dominati dall'insulina, dall’IGF (insulin-like growth factor 1), dagli ormoni sessuali e dalle adipochine. La tumorogenesi, comunque, si verificherebbe a causa di mutazioni con il conferimento di una serie di caratteristiche specifiche del cancro, tra cui l’autosufficienza dei segnali di crescita e il distacco dall’apoptosi. Molti geni che provocano il cancro codificano le proteinchinasi il cui dominio è quello funzionale più comunemente trovato e conosciuto nei geni del cancro. Questi enzimi, che occupano posizioni apicali nelle cascate della trasduzione del segnale e i cui effetti delle attività aberranti cellulari sono diffusi ad ampio raggio, s’integrano con molti altri percorsi di segnalazione per regolare l'attività o l'abbondanza dei fattori di trascrizione. L'importanza funzionale di questa capacità acquisita per la manifestazione della malattia è stata ulteriormente convalidata dal riconoscimento degli inibitori della tirosinchinasi nelle terapie contro il cancro, in particolare, quelli rivolti alle vie di segnalazione BCR Abl e CKIT.
Lo stesso vale per la segnalazione endogena ormonale integrantesi con gli altri fattori della cascata di trasduzione del segnale per controllare una varietà di processi, compresi quelli dell’espressione genica.
Giovannucci E dell’Harvard Medical School, Boston, MA - USA osservò già nel 1994 che alcuni fattori, legati all’occidentalizzazione o all’aumento dell'industrializzazione, potevano essere imputati dell’accresciuto rischio del cancro al colon. Si riteneva ampiamente, in effetti, che questa condizione fosse correlata agli effetti diretti dei grassi alimentari e delle fibre nel lume del colon (Cancer Causes Control. 1995 Mar;6 (2):164-79).
Tuttavia, le ipotesi dei grassi e delle fibre, almeno nella loro formulazione originale, non spiegavano adeguatamente i numerosi reperti che emergevano dagli studi epidemiologici. L’Autore, così, avanzò l’ipotesi alternativa dell'iperinsulinemia, come causa di promozione della carcinogenesi del colon. Faceva notare che l'insulina, in effetti, era un importante fattore di crescita delle cellule epiteliali del colon e un mitogeno della crescita delle cellule tumorali in vitro. Le evidenze epidemiologiche a supporto di questa ipotesi erano, peraltro, in gran parte indirette e si basavano sulla somiglianza dei fattori che producevano gli elevati livelli d’insulina con quelli riguardanti il rischio del cancro del colon. In particolare, l'obesità, soprattutto quella centrale, l’inattività fisica ed eventualmente il basso contenuto dei grassi polinsaturi nella dieta in rapporto a quelli saturi erano i principali determinanti della resistenza all'insulina e dell’iperinsulinemia. Apparivano, difatti, correlati al rischio del cancro al colon. Inoltre, la dieta, ricca di carboidrati raffinati e povera di fibre solubili in acqua, era anche associata all’aumentato rischio del cancro al colon, poiché provocava un rapido assorbimento intestinale del glucosio nel sangue che causava l’iperinsulinemia postprandiale. Pertanto, la combinazione della resistenza all'insulina e dell’alto carico glicemico produceva i livelli particolarmente elevati dell’insulina. L’iperinsulinemia, così, poteva spiegare il legame tra l'obesità, l’inattività fisica e la dieta povera di frutta e verdura e ricca di carne rossa e gli alimenti ampiamente trasformati con il rischio del cancro al colon. Queste condizioni particolari si riscontravano, peraltro, comunemente nei Paesi occidentali. L’insulina, in effetti, è un ormone cruciale per i processi anabolizzanti coinvolti nella crescita precoce e lo sviluppo e costituisce anche un forte mediatore degli effetti negativi dell'obesità sulla prognosi del cancro.
Il peso corporeo in eccesso, l’aumento dei trigliceridi plasmatici, i bassi livelli di attività fisica e certi modelli dietetici possono, quindi, tutti concorrere agli elevati livelli circolanti dell’insulina. Di poi, l’aumento cronico delle concentrazioni d’insulina riduce la sintesi dell’IGFBP-1 e 2 con conseguente aumento dei livelli dell’IGF-1 Bio-Active® libero e delle concomitanti variazioni dell'ambiente cellulare con sviluppo favorevole del tumore. Inoltre, l'ormone della crescita (GH) fornisce lo stimolo principale per la sintesi dell’IGF-1 nel fegato, sorgente di oltre l’80% dell’IGF-1 circolante.
L’insulina e l’IGF-1 impedirebbero, quindi, l'apoptosi e promuoverebbero la proliferazione cellulare. L’iperinsulinemia innescherebbe il percorso complesso insulino-IGF. Questo comprende, in particolare, l’insulina, l’IGF-1, l’IGF-2 (tre ligandi), insieme a sei recettori (recettore insulinico α, IR β, recettore IGF-1, IGF-2R, IGF-1R / IR α ibrido e IGF-1R / IR β ibridi) e le sette proteine leganti l’IGF. S’ipotizza, pertanto, che l'aumento del livello d’insulina ridurrebbe la quantità dell’IGFBPs, portando a un aumento il livello dell’IGF-1 e a un cambiamento nell'ambiente cellulare che promuoverebbe la crescita tumorale. L'ormone della crescita regolato dall’insulina stimolerebbe la produzione dell’IGF-1 e dell’IGFBP-3. I percorsi ipotizzati sono stati, peraltro, dimostrati in studi in vitro e in vivo sugli animali. Nelle metanalisi un aumento del livello dell’IGF-I è stato dimostrato associato a un aumentato rischio dei tumori al seno in pre e post-menopausa e del cancro della prostata. D'altra parte, studi che hanno misurato l’IGFBP-3 hanno anche dato risultati inconsistenti. Una stima della totalità di mortalità del cancro, in conformità a un gruppo di 633 uomini di età cinquanta anni e anche più anziani, ha, peraltro, indicato un rischio significativamente più elevato di morte per il cancro associato ai più alti livelli dell’IGF-I dopo aggiustamento per età, per IGFBP-1, per adiposità, per esercizio fisico, per corrente abitudine al fumo e per cancro già preesistente. È stato anche dimostrato che le variazioni nei livelli dell’IGF-1 e dell’IGFBP-3 circolanti possono essere correlate a quelle dei geni IGF1, SSTR5, IGFBP3 e IGFALS.
In particolare, poi, l’evidenza di tutto ciò risiederebbe nel possibile effetto degli ormoni sessuali e nel legame tra l’obesità e il cancro dei tumori considerati ormono-dipendenti, come quello dell’endometrio, della mammella, dell'utero, delle ovaie e della prostata.
Bisogna, a tal proposito, ricordare che:
- Gli ormoni sessuali steroidei sono prodotti principalmente dalle ghiandole surrenali, gli endogeni comprendono il progesterone, gli estrogeni (E1-E2-estrone ed estradiolo), il testosterone, l’androstenedione, il diidrotestosterone e il deidroepiandrosterone.
- L’estrogeno, per esempio, si lega al recettore ER, attivando le vie di segnalazione intracellulari che avvieranno con lo stimolo della divisione cellulare la progressione tumorale.
- L’eccesso dell’aromatasi, derivata dal tessuto adiposo, può portare l’estradiolo non legato a livelli ancora più elevati, provocando altri danni al DNA.
- Gli estrogeni interagiscono anche con l’IGF, che promuove la crescita tumorale attraverso l'inibizione dell’apoptosi.
Inoltre, come possibile legame tra l’obesità e il cancro sono state indicate le adipochine, ormoni prodotti dal tessuto adiposo. A tale proposito, sono state studiate la leptina, l’adiponectina, la resistina e la visfatina.
È noto che la leptina sopprime l'appetito indirettamente, attraverso un aumento dei livelli dell’ormone-α-melanocita stimolante e vincolante dei recettori melanocortinici. I tumori del colon, della prostata e della mammella sono stati associati, quindi, con un aumento dei livelli di leptina sierica. Tuttavia, la consistenza degli effetti della leptina sulla tumorigenesi dei vari tipi di cancro è ancora oggetto di studio.
L'adiponectina, invece, è stata trovata associata negativamente con il rischio di cancro dell'endometrio, della mammella, del colon e della prostata.
L'effetto della resistina e della visfatina, per altro canto, non è stato ben studiato.
La resistina, inizialmente descritta come un ormone specifico degli adipociti modulante l’insulino-resistenza nei roditori, può presentare proprietà proliferative, antiapoptotiche, proinfiammatorie, proangiogeniche e metastatiche. Evidenze accumulate nel tempo supportano un suo ruolo come fattore di rischio e come potenziale biomarcatore diagnostico e prognostico nel cancro.
La visfatina è principalmente in fase di studio in vitro e tra i pazienti con diabete di tipo II per imitare gli effetti dell’insulina. Il suo rapporto con il cancro è stato osservato, però, solo nei pazienti con carcinoma colorettale.
Altre prospettive sui meccanismi biologici con cui l'obesità può influenzare il cancro risiedono nell’ipossia, nella suscettibilità genetica comune, nella migrazione delle cellule stromali adipose e in altre condizioni biologiche, quali l’infiammazione cronica di basso grado, lo stress ossidativo e il sistema factorkB nucleare.
Esse indicano il rapporto tra ATH (adipose tissue hypoxia) e lo sviluppo dell’insulino-resistenza che porta alla riduzione dell’adiponectina e all’aumento dell'espressione genica della leptina. D’altra parte, lo studio in vivo ha dimostrato la possibilità dei livelli di ossigeno più bassi nei topi obesi rispetto ai magri. Sempre studi in vitro hanno trovato che il melanoma si sviluppa più rapidamente in un microambiente ipossico.
Con il miglioramento della tecnologia e il ritmo accelerato negli studi di associazione sull'intero genoma, la genetica dell’obesità e il suo rapporto con i geni del cancro sono stati più ampiamente studiati nei riguardi delle neoplasie della mammella e del colon-retto. In effetti, quando la mappa genica dell'obesità si sovrappone con quella del cancro, sembrano esserci collegamenti con i cromosomi 11p e 16q del cancro al seno e 18q di quello colorettale.
La migrazione delle cellule stromali adipose è stata anche oggetto d’ipotesi come meccanismo del potenziale sviluppo di neovascolarizzazione con apporto delle sostanze nutrienti e dell’ossigeno alle cellule tumorali. L’aumento del tessuto adiposo bianco, a sua volta, promuovendo la crescita tumorale, è stato dimostrato correlato a un aumento del reclutamento delle cellule stromali ed endoteliali adipose per quelle tumorali.
Di certo, una prova sostanziale è costituita dal rapporto, che avrebbe dovuto includere anche la tumorigenesi, tra l'obesità, l’infiammazione cronica e la resistenza all'insulina. Tuttavia, di tutto questo non vi è stata ancora una forte evidenza. Un’associazione tra l’aumento della proteina C-reattiva e lo sviluppo del cancro del colon-retto ha prodotto risultati non univoci. Il NF-kB (nuclear factor-kappaB), che promuove l'infiammazione attraverso un aumento della produzione delle citochine, si è dimostrato associato alla tumorigenesi del cancro derivato dalla colite, ma non negli esseri umani. Si è anche ipotizzato che l'obesità, potendo diminuire l'attività antiossidante e indurre uno stress ossidativo, possa attivare i percorsi NF-kB che promuovono la crescita tumorale.
In definitiva, come convenuto dagli studiosi, la condizione molto importante nello studio del rapporto tra l'obesità e il cancro è quella legata all’elevata eterogeneità delle due patologie. Questo dato di fatto dovrebbe costituire, quindi, una premessa inequivocabile nello studio dell’associazione tra le due malattie.
Renehan AG dell’University of Manchester, UK e collaboratori hanno eseguito una revisione sistematica e una meta-analisi della letteratura su venti tipi di cancro per valutare la forza delle associazioni con le differenze per sesso ed etnia tra l’aumento della BMI di 5 kg / m2 e il cancro di diversa sede (Lancet. 2008 Feb 16;371 (9612):569-78).
Gli Autori analizzavano, così, 221 set di dati (141 articoli), con 282.137 casi incidenti.
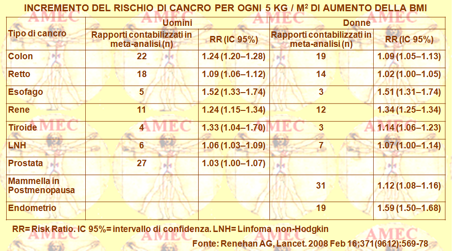
Negli uomini un aumento della BMI di 5 kg / m2 era fortemente associato con l’adenocarcinoma dell’esofago (RR 1,52, p <0,0001), della tiroide (1.33, p = 0,02), del colon (1.24, p <0,0001) e del rene (1.24, p <0,0001). Nelle donne, vi erano forti associazioni tra un aumento della BMI di 5 kg / m2 con l’adenocarcinoma dell'endometrio (1,59, p <0,0001), della colecisti (1,59, p = 0,04), dell’esofageo (1.51, p <0,0001) e del rene (1.34, p <0,0001). Si registravano negli uomini deboli associazioni positive (RR <1.20) tra l'aumento della BMI e il cancro del retto e il melanoma maligno. Nelle donne si notava la stessa correlazione con il cancro del seno in postmenopausa, del pancreas, della tiroide e dei tumori del colon. In entrambi i sessi si riscontravano le stesse correlazioni con la leucemia, il mieloma multiplo e il linfoma non-Hodgkin. Le associazioni per il cancro del colon erano, comunque, più forti negli uomini rispetto alle donne (p <0,0001). Erano generalmente simili in studi provenienti dall’America settentrionale, dall’Europa, dall’Australia e dalla regione dell’Asia- Pacifico. Pur tuttavia, le associazioni più forti registrate nelle popolazioni dell'Asia - Pacifico erano tra l'aumento della BMI e i tumori al seno in premenopausa (p = 0,009) e in postmenopausa (p = 0,06).
In conclusione, l’aumento della BMI si associava a un più elevato rischio di tumori e non solo in quelli comuni. Per alcuni tipi di cancro le associazioni differivano tra i sessi e tra le popolazioni di diverse origini etniche, portando alla considerazione dell’importanza dell’esplorazione dei meccanismi biologici che collegano l'obesità con il cancro.
Per quanto riguarda il rischio di tumori nell’eccesso di peso, Pischon T del German Institute of Human Nutrition Potsdam-Rehbrueck e collaboratori, hanno rilevato l’evidenza dell’associazione in diverse forme di cancro, come quello al seno in post-menopausa, all'endometrio, al colon, al rene e all'esofago (Proc Nutr Soc. 2008 May;67 (2):128-45).
Nella loro analisi gli Autori dimostravano che gli obesi presentavano, rispetto ai soggetti normopeso, un rischio maggiore di sviluppare questi tumori da 1,5 a 3,5 volte.
A riguardo del lavoro appena citato, bisogna considerare che vi sono state stime secondo le quali il contributo dell'obesità e del sovrappeso con una BMI tra i 25,0 e i 29,9 kg / m2 all’insorgenza di questi tumori in Europa variava dal 15 al 45%. Peraltro, altri studi avevano suggerito anche la responsabilità dell'obesità nell’aumento del rischio di altri tipi di cancro, tra cui quello del pancreas, del fegato e della colecisti.
I meccanismi alla base di questa condizione non erano ancora tutti chiariti e avrebbero avuto la possibilità di variare in rapporto al tipo del tumore e anche alla differente distribuzione del grasso corporeo. Così, l'obesità addominale come definita dalla circonferenza della vita o dal rapporto vita/fianchi, avrebbe dimostrato di essere più fortemente correlata a certi tipi di cancro, rispetto a come definita dalla BMI.
Karen Basen-Engquist dell’University of Texas, Houston – USA, proprio considerando l’aumento della prevalenza dell’obesità e del sovrappeso in tutto il mondo con crescita delle evidenze alla base del legame tra di loro, hanno cercato di fornire i dati della ricerca, con particolare attenzione per gli studi epidemiologici (Curr Oncol Rep. 2011 Feb; 13 (1): 71–76).
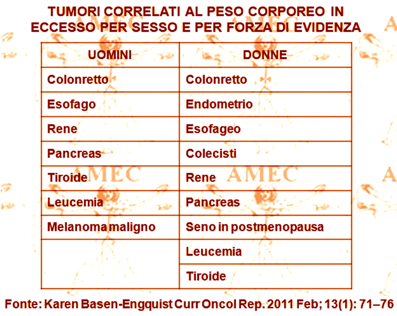
Inoltre, gli Autori hanno cercato di rivedere in breve i meccanismi ipotizzati alla base del rapporto tra l’obesità e il cancro, riportando che negli Stati Uniti circa 85.000 nuovi casi di cancro annuali erano connessi all'obesità e che le ricerche avevano rilevato che l’aumento di 5 kg / m2 dell’indice di massa corporea comportava la crescita della mortalità per cancro del 10%. Peraltro, chi era stato sottoposto alla chirurgia bariatrica, in particolare per le donne, sperimentava in rapporto alla perdita di peso una riduzione dell’incidenza e della mortalità del cancro.
Jennifer A. Ligibel del Dana-Farber Cancer Institute, Boston, MA e collaboratori hanno pubblicato recentemente alcuni dati sulle relazioni tra l’obesità e il cancro, descrivendo le iniziative e le priorità dell’ASCO (American Society of Clinical Oncology) nei meriti (JCO 2014.58.4680).
La ricerca dimostrava, in effetti, che dopo la diagnosi di cancro era necessario motivare gli individui verso i comportamenti di riduzione del rischio. Per questo motivo bisognava aiutare i pazienti a perdere peso e a fare altri cambiamenti di stile di vita sano. In effetti, l'American Society of Clinical Oncology è impegnata a ridurre l'impatto dell'obesità sul cancro e ha stabilito iniziative su più fronti per raggiungere quest’obiettivo secondo i seguenti criteri:
- Aumentare l'educazione e la consapevolezza delle evidenze che collegano l'obesità con il cancro.
- Fornire strumenti e risorse per contribuire ad affrontare l’obesità.
- Costruire e promuovere un programma di ricerca robusto per meglio comprendere la fisiopatologia delle alterazioni dell'equilibrio energetico, per valutare l'impatto del cambiamento del comportamento sui risultati del cancro e per determinare i metodi migliori per aiutare i sopravvissuti al cancro ad apportare le modifiche più efficaci e utili agli stili di vita.
- Sostenere le politiche e i sistemi di cambiamento per affrontare i fattori sociali che contribuiscono all'obesità. Migliorare l'accesso ai servizi di gestione del peso per i pazienti con cancro.
Thomson CA dell’University of Arizona e collaboratori hanno progettato un’analisi per valutare il rischio di tumore maligno nelle donne randomizzate a dieta povera di grassi del 40%, rispetto a quella abituale del 60% (Cancer Epidemiol Biomarkers Prev. 2014 Dec;23 (12):2924-35).
Gli Autori sono stati motivati dal precedente risultato delle DM (dietary modification) a basso contenuto di grassi (20% kcal) nel WHI (Women's Health Initiative) 1993-2005 con una riduzione non significativa del cancro al seno, una riduzione nominalmente significativa in quello ovarico e nessun effetto su altri tipi di tumore (media 8,3 anni d’intervento).
Si eseguiva, quindi, uno studio randomizzato, controllato con intervento di dieta povera di grassi per la prevenzione dei tumori al seno e colorettali in postmenopausa in 48.835 donne americane di età dai cinquanta ai settantanove anni in quaranta sedi degli Stati Uniti.
Gli esiti includevano il cancro totale invasivo, quello al seno, il colorettale, quello specifico e la mortalità complessiva.
Per il cancro al seno invasivo l’hazard ratio (HR) e l’intervallo di confidenza (IC) il 95% erano 0,92 (0,84-1,01) durante l'intervento, 1,08 (0,94-1,24) durante il periodo post-intervento e 0,97 (0,89-1,05) durante il follow-up cumulativo. Durante il follow-up per i tumori con recettore positivo per gli estrogeni / negativo per il progesterone si dimostrava una riduzione del rischio. Nelle donne con più alta assunzione di grassi al basale (quartile), le stime puntuali di rischio del cancro al seno erano HR= 0,76 (IC 95%= 0,62-0,92) durante l'intervento contro un HR= 1.11 (IC 95%= 0,84-1,4) durante il follow-up post-intervento (pdiff = 0,03).
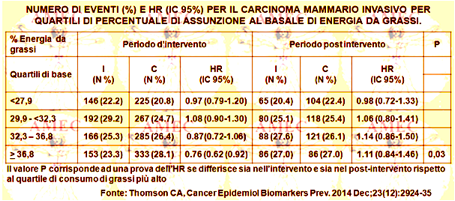
In conclusione, nello studio WHI DM l'assunzione maggiore dei grassi nelle donne non dimostrava a lungo termine alcuna riduzione del rischio del cancro o della mortalità. Non ne derivava, quindi, in generale alcun suggerimento di riduzione del grasso alimentare per la prevenzione del cancro dopo la menopausa.
A proposito di questi risultati, Terry M. Gibbs del Flower Hospital, Sylvania, OH ricordava come molti ricercatori avevano collegato, in effetti, le abitudini alimentari e, soprattutto, l'assunzione dei grassi con il rischio del cancro. Thomson e colleghi avevano presentato, invero, il primo studio a lungo termine randomizzato e controllato in materia, come continuazione della sperimentazione del Women’s Health Initiative Dietary Modification trial. In particolare, gli Autori avevano ipotizzato che, riducendo l'assunzione dei grassi a meno del 20% del consumo totale di calorie, avrebbero potuto osservare un impatto positivo sull'incidenza del cancro al seno invasivo e di quello colorettale. Pur tuttavia, mentre i rapporti iniziali avevano indicato una modesta riduzione del rischio di alcuni tumori associati a questo cambiamento di dieta, i dati del follow-up a lungo termine avevano rivelato che la riduzione del rischio, in precedenza apprezzato, non era stata mantenuta. Peraltro, era stato importante che le rettifiche per la variazione del peso e l'indice di massa corporea non avessero influenzato l’hazard ratio.
Pertanto, anche se gli Autori avevano riferito che le statistiche non avevano supportato la loro ipotesi generale, si doveva ricordare che il risultato dell'intervento stesso aveva interessato una diminuzione sensibile di alcuni tassi di cancro, in particolare quello al seno nel sottotipo di recettore positivo degli estrogeni / negativo del progesterone. Tuttavia, come osservato in molti studi sulle modifiche dello stile di vita, quelle temporanee non necessariamente avevano offerto significativi benefici a lungo termine. Era interessante notare, però, che il rischio di cancro del colon-retto era aumentato nelle partecipanti durante la fase d’intervento, mentre era diminuito durante la fase post-intervento. Questi risultati avevano convinto a sostenere la consulenza dei pazienti per le modifiche dello stile di vita per tutta l’esistenza e non solo temporaneamente. Inoltre, la capacità di quantificare la riduzione del rischio che si sarebbe potuta godere impegnandosi in tali cambiamenti dello stile di vita era stata molto importante, poiché questi dati, una volta presentati alle pazienti, avrebbero potuto guidare la comunicazione e il rapporto medico-paziente. Sarebbero, quindi, potuti servire come motivazione per influenzarle attivamente contro il rischio di sviluppare il cancro. Lo studio, comunque, aveva incluso solo le donne la cui assunzione dei grassi al basale era superiore al 32% del consumo energetico complessivo. Peraltro, la maggior parte era in sovrappeso o obesa e le riduzioni più drastiche del rischio erano state osservate nelle donne che avevano segnalato il più alto consumo di base di grassi. Inoltre, i ricercatori avevano focalizzato la loro attenzione solo sull’assunzione dei grassi in generale, piuttosto che sul tipo specifico degli stessi.
In una successiva analisi, Melina Arnold dell’IARC (International Agency for Research on Cancer) e collaboratori, proprio in rapporto all’associazione tra l’alto BMI (High body-mass index), uguale o superiore a 25 kg / m2, con l’aumento del rischio del cancro, hanno inteso stimare il carico globale attribuibile nei meriti per il 2012 (Lancet Oncol, Volume 16, No. 1, p36–46, January 2015).
Gli Autori con questo studio di popolazione si ponevano l’obiettivo di informare la politica di sanità pubblica e la ricerca su questa importante problematica.
Derivavano, quindi, i PAF (population attributable fractions), usando i relativi rischi e le stime del BMI negli adulti per età, sesso e il paese di origine. Assumendo un periodo d'intervallo di dieci anni tra l’alto BMI e l’insorgenza del cancro, calcolavano il PAF con le stime del BMI dal 2002 e utilizzavano i dati del GLOBOCAN 2012 per il numero dei nuovi casi di cancro attribuibili all’eccesso di peso. Calcolavano anche la percentuale dei tumori che erano potenzialmente evitabili, qualora si fossero mantenute le BMI medie, registrate nel 1982. Inoltre, si eseguivano analisi secondarie per testare il modello e stimare gli effetti della HRT (hormone replacement therapy) utilizzata e del fumo.
Lo studio, metteva, così, in evidenza che il sovrappeso e l’obesità erano diventati un importante fattore di rischio, responsabile di 481.000 nuovi casi di cancro nel 2012, corrispondenti a circa il 3,6% di tutte le neoplasie maligne.
Più precisamente l’analisi globale mostrava che nei Paesi più sviluppati il cancro a causa del sovrappeso e dell’obesità era molto più comune con 393.000 casi, pari al 5,2% di tutti i nuovi casi. Nei Paesi meno sviluppati il numero era inferiore e corrispondeva a 88.000 casi, pari all'1,5% di tutti i nuovi casi. L’America settentrionale rimaneva l’area più colpita, con 111.000 tumori correlati all'obesità nel 2012, pari al 23% del carico globale del cancro totale legato all’alta BMI.
Anche in Europa, la proporzione dello stesso tipo di tumori assumeva grandi dimensioni, in particolare nell’area orientale con 65.000 casi, il 6,5% di tutti i nuovi casi di cancro di tutto il continente.
Nel complesso, i Paesi con il più alto carico di cancro attribuibile al sovrappeso e all’obesità erano negli uomini la Repubblica Ceca (5,5% dei nuovi casi di cancro del Paese), la Giordania (4,5%), il Regno Unito (4,4%) e Malta (4,4%). Tra le donne, le aree più colpite erano le Barbados (12,7%), la Repubblica ceca (12,0%) e Puerto Rico (11,6%).
Nei Paesi asiatici, sebbene per la maggior parte la proporzione di cancro associato con il sovrappeso e l’obesità non fosse grande, si rilevava, comunque, un notevole numero assoluto dei casi a causa della grande dimensione della popolazione. In Cina, per esempio, si contavano circa 50.000 casi di cancro associati con il sovrappeso e l'obesità in ambo i sessi. Questi casi rappresentavano l’1,6% dei nuovi cancri del Paese. In Africa, invece, il cancro associato al sovrappeso e all'obesità corrispondeva, con i più bassi valori, a 7.300 casi, l’1,5% di tutti i nuovi casi di cancro nel continente.
In definitiva, il cancro associato al sovrappeso e all’obesità rimaneva alto nei paesi più ricchi e presentava livelli inferiori nelle parti del mondo in via di sviluppo.
In effetti, i PAF erano maggiori nelle donne rispetto agli uomini (5,4% vs 1,9%). L'onere dei casi attribuibili era maggiore nei paesi con HDI (human development indices) molto alto e alto (HDI; PAF 5,3% e 4,8% rispettivamente), rispetto a quelli con HDI moderato (1,6%) e basso (1,0%). Il cancro del corpo uterino, quello del seno in post-menopausa e quello del colon rappresentavano il 63,6% di tutti i tumori attribuibili all’elevato indice di massa corporea. Un quarto (circa 118.000) dei casi di cancro nel 2012 dal 1982 si sarebbe, così, potuto attribuire all'aumento della BMI.
Questi risultati rimarcavano, secondo gli Autori, la necessità di uno sforzo globale per ridurre il crescente numero delle persone con alto indice di massa corporea. Il cancro al seno in post menopausa, all'endometrio e al colon erano responsabili per quasi tre quarti dell’onere del cancro legato all'obesità nelle donne (quasi 250 000 casi), mentre negli uomini quello del colon e del rene rappresentavano oltre i due terzi (circa 90.000 casi). Nei Paesi con HDI molto alto e alto, circa l'8% dei casi di cancro nelle donne e il 3% negli uomini erano associati con l’eccesso di peso corporeo, rispetto ad appena lo 1,5% dei casi di cancro nelle donne e circa lo 0,3% negli uomini nelle aree in via di sviluppo con basso HDI. In Europa l'onere era grande nell’area orientale con oltre un terzo del totale dei casi europei a causa dell’eccesso della BMI (66.000 tumori).
In definitiva, supponendo che l'associazione tra BMI elevata e cancro fosse stata causale, la continuazione degli attuali modelli di aumento di peso della popolazione dovrebbe portare a continui aumenti nel futuro dell’onere di cancro, soprattutto in America settentrionale e in Europa.
Eccesso di peso e cancro della tiroide
Studi epidemiologici hanno finora dimostrato l’associazione tra l’obesità e l'aumento del rischio del cancro alla tiroide, la cui incidenza dal 1980 negli Stati Uniti è stata segnalata con aumento drammatico di circa tre volte.
La maggior parte di quest’aumento è sostenuta dal PTC (papillary thyroid cancer) e non è ancora chiaro se la causa possa essere il risultato di un maggiore rischio di sviluppo della neoplasia o di un aumento delle capacità del suo rilevamento in rapporto alle nuove e più sensibili tecnologie di diagnosi. Indipendentemente da ciò, comunque, il cancro della tiroide rimane il tumore endocrino più comune ed è responsabile di un maggior numero di morti ogni anno, rispetto a tutti gli altri tumori maligni endocrini combinati insieme.
Pur tuttavia, nonostante il grande interesse derivato dal crescente numero di diagnosi di questa temibile malattia, oltre alle radiazioni ionizzanti durante l'infanzia e alla storia clinica di gozzo o di noduli, si annoverano pochi fattori di rischio diffusamente riconosciuti. Inoltre, non sono ancora chiari tutti i meccanismi che potrebbero essere alla base della sua insorgenza.
L’obesità, comunque, come riportato fattore di rischio già riconosciuto per una varietà di tumori nella popolazione dei pazienti di tutto il mondo, è stata direttamente collegata in alcuni studi degli Stati Uniti, della Corea, della Norvegia e della Polinesia Francese con l’aumento dell'incidenza del cancro alla tiroide.
Mijovic T della McGill University, Montreal, Quebec, Canada e collaboratori nel 2011 hanno prodotto una revisione concentrata sulle evidenze che collegavano il cancro della tiroide con l'obesità (Front Biosci (Schol Ed). 2011; 3:555-64).
Gli Autori concludevano che vi erano prove sufficienti per confermare che l'obesità potesse predisporre a un aumentato rischio del cancro alla tiroide negli uomini e nelle donne. Peraltro, quest’associazione poteva trarre la sua spiegazione principalmente a livello biologico, attraverso le specifiche endocrinopatie correlate con l'obesità.
Sempre a tal proposito, Cari M Kitahara del National Cancer Institute, NIH, Rockville e collaboratori hanno voluto esaminare, l'associazione tra l’indice di massa corporea (BMI) e il rischio di cancro della tiroide in un'analisi congiunta di cinque studi prospettici americani comprendenti 413.979 donne e 434.953 uomini (Cancer Epidemiol Biomarkers Prev. 2011 March; 20 (3): 464–472).
I modelli proporzionali di rischio con l'età raggiunta erano aggiustati per l'istruzione, la razza, lo stato civile, il fumo, l’assunzione di alcol e il sesso. Nel corso del follow-up, di durata media di 10,3 anni, 768 donne e 388 uomini ricevevano la diagnosi di cancro alla tiroide. Il rischio era maggiore con l'aumentare della BMI, così che per 5 kg/m2 l’hazard ratio [HR] nelle donne era 1.16 [intervallo di confidenza 95% (IC), 1,08-1,24], mentre negli uomini 1,21 [95% IC, 0,97-1,49]). Non c'era una significativa eterogeneità tra gli studi (entrambi p> 0,05). Sia per le donne e sia per gli uomini gli HR per il sovrappeso (25,0-29,9 kg/m2) e l'obesità (≥ 30 kg/m2), in confronto con i pazienti di peso normale (18,5-24,9 kg/m2), erano 1,20 (95% IC, 1,04-1,38) e 1.53 (95% IC, 1,31-1,79) rispettivamente. Non si riscontrava nessun effetto di modifica significativa da altri fattori e i risultati non mostravano differenze significative nel tipo istologico. Si osservava anche una significativa associazione positiva tra il rischio di cancro della tiroide e la BMI in età adulta dai diciotto ai venti anni. Per 5-kg/m2 di aumento lo HR era 1.18 [IC 95%, 1,03-1,35]).
In conclusione, la BMI era positivamente associata al rischio del cancro della tiroide in entrambi gli uomini e le donne. In definitiva si dimostrava, secondo gli Autori, la forte evidenza nel loro studio che l'obesità era un fattore di rischio indipendente per la neoplasia.
In seguito, Cari M. Kitahara e collaboratori hanno valutato 575 polimorfismi a singolo nucleotide in ventitré regioni correlate al gene dell'obesità in uno studio caso-controllo su 341 casi di cancro della tiroide papillare (PTC) e in 444 controlli di origine europea (Cancer Epidemiol Biomarkers Prev; 1–4. ©2012 AACR).
Gli Autori hanno utilizzato modelli di regressione logistica, aggiustati per l'età raggiunta, l’anno di nascita e il sesso, per calcolare l’OR e gli intervalli di confidenza al 95% (IC) per i genotipi SNP codificati come zero, uno, due e modellati continuamente per il calcolo della P. Nove dei primi dieci SNP in classifica (P <0.01) erano localizzati nella regione del gene FTO (fat mass and obesity associated), mentre il decimo si trovava nell’INSR (insulin receptor). Nessuna delle associazioni risultava significativa dopo la correzione per i test multipli.
In conclusione, gli Autori affermavano che i loro dati, nel determinare il rischio di PTC, non supportavano un importante ruolo dei polimorfismi genetici in correlazione con l'obesità.
Marcello MA dell’University of Campinas, São Paulo, Brazil e collaboratori, in ragione del fatto che i dati contrastanti sull'associazione tra obesità e DTC (differentiated thyroid cancer) potevano essere attribuiti alla mancanza di documentazione che dimostrasse la valutazione adeguata della composizione dei nutrienti assunti con la dieta, hanno valutato 115 pazienti accuratamente abbinati con 103 soggetti sani di controllo, utilizzando un questionario strutturato (Nutr Cancer. 2012; 64 (8):1190-5).
Gli Autori hanno, così, osservato che l'eccesso di peso, secondo l’indice di massa corporea maggiore di 25 kg / m2, aumentava la suscettibilità individuale al DTC [odds ratio (OR) = 3.787; intervallo di confidenza (IC) 95% = 1,115-6,814; P <0,0001). Quest’aumento del rischio era, poi, evidente nelle donne (OR = 1.925; IC 95% = 1,110-3,338, p = 0,0259), ma non negli uomini (p = 0,3498). Inoltre, l'assunzione di calorie in eccesso era più frequente nei pazienti con DTC, rispetto ai controlli (OR = 5.890; IC 95% = 3,124-11,103, p <0.0001). Peraltro, entrambi i consumi delle proteine (OR = 4.601; IC 95% = 1,634-12,954; P = 0,0039) e dei carboidrati in eccesso (OR = 4.905; IC 95% = 2,593-9,278, p <0,0001) erano associati a un aumento del rischio di DTC, contrariamente a quanto riguardava i lipidi / l’assunzione di fibre e l'attività fisica (P = 0,894 e 0,5932, rispettivamente).
In conclusione, secondo gli Autori, i loro dati indicavano che il sovrappeso e il rischio di DTC erano associati al consumo di proteine e di carboidrati superiori alle quote raccomandate dall'Organizzazione Mondiale della Sanità. Pertanto, l'orientamento nutrizionale avrebbe dovuto far parte degli obiettivi della strategia di prevenzione intesi a combattere la crescente incidenza dell’obesità e anche del DTC.
Avital Harari dell’UCLA David Geffen School of Medicine, Los Angeles, California e collaboratori, per definire la possibile maggiore aggressività del PTC (papillary thyroid cancer) in rapporto all’aumento dell'indice di massa corporea (BMI), hanno svolto una revisione retrospettiva di un database prospettico (Arch Surg. 2012;147 (9):805-811).
Gli Autori hanno, così, analizzato un totale di 443 pazienti di età superiore ai diciotto anni, sottoposti a tiroidectomia totale per PTC dal primo gennaio 2004 fino al 31 marzo 2011. I partecipanti di età dai diciotto agli ottantanove anni erano suddivisi in quattro gruppi sulla base della BMI:
- Normalità da 18,5 a 24,9.
- Sovrappeso da 25,0 a 29,9.
- Obesità da trenta a 39,9.
- Obesità patologica uguale o superiore a quaranta.
Le principali misure di esito erano lo stadio della malattia al momento della presentazione, il sottotipo istologico, la durata dell’induzione dell'anestesia e dell'estubazione, la durata dell'intervento, le complicanze chirurgiche, la durata della degenza ospedaliera e la classe ASA (American Society of Anesthesiologists).
La maggiore BMI si associava con lo stadio di malattia più avanzato al momento della presentazione (P <.001) e al sottotipo istopatologico PTC più aggressivo (P = .03). I pazienti obesi presentavano più frequentemente uno stadio III o IV della malattia (odds ratio, 3.67, P <.001). La maggiore BMI era collegata anche con la durata più lunga dell’induzione dell'anestesia (P <.001), con l’aumento della durata della degenza (P <.001) e con la più alta classe ASA (P <.001). La durata dell’atto chirurgico non era, invece, associata con la BMI. C'era, peraltro, una tendenza con l'aumento del BMI verso i tumori più grandi (p = .06). Gli obesi andavano anche incontro più frequentemente alla paralisi preoperatoria delle corde vocali a causa dell’invasione locale (odds ratio, 9.21, P = .001).
In conclusione, i pazienti obesi presentavano forme di PTC in uno stadio più avanzato e in una forma più aggressiva, stimolando il suggerimento di doverli sottoporre a un attento screening per il cancro della tiroide.
Zhao ZG della Baotou Tumour Hospital, China e collaboratori hanno esaminato in una metanalisi la relazione tra l’eccesso del peso e l’indice di massa corporea (BMI) con il rischio del cancro alla tiroide, ricorrendo agli studi di coorte rilevati nella letteratura (J Int Med Res. 2012;40 (6):2041-50).
Sette studi, per un numero totale di 5.154 casi di cancro alla tiroide, raggiungevano i criteri d’inclusione. Il rischio relativo complessivo (RR) del cancro alla tiroide per il sovrappeso era 1,13 con intervallo di confidenza [IC] 95%= 1.04, 1.22. Anche l'obesità era collegata a un aumento del rischio in entrambi i sessi e la forza dell'associazione cresceva con l'aumento della BMI. Il RR combinato del cancro della tiroide era 1,18 (IC 95%= 1.11, 1.25), sia per l’eccesso del peso corporeo e sia per quello combinato con l’obesità.
La condizione di sovrappeso era associata con un aumento significativo del rischio di cancro alla tiroide tra i non asiatici, ma non tra gli asiatici. Il sovrappeso, l’obesità e il peso corporeo in eccesso erano tutti associati con il rischio di carcinoma papillare della tiroide.
In conclusione, in questa disamina si aveva conferma dell'associazione tra obesità / sovrappeso e rischio di cancro alla tiroide.
Eccesso di peso e cancro del polmone
Il tumore del polmone rimane ancora oggi una neoplasia a prognosi particolarmente sfavorevole. Nel 2006 in Italia si contavano complessivamente 75.365 persone affette dalla malattia, pari al 3,4% di tutti i pazienti con diagnosi di neoplasia. Nel 2013 si registravano 38.000 nuove diagnosi, corrispondenti all’11% di tutte le nuove diagnosi di tumore nella popolazione generale, e in particolare il 15% nei maschi e il 6% nelle femmine. La mortalità, sempre nel 2013, era pari a 34.000 decessi. In tal modo, il cancro al polmone rappresentava la prima causa di morte per neoplasia nei maschi con il 26% dei decessi totali e la terza nelle donne con l’11%.
La percentuale di sopravvivenza a cinque anni era moderatamente aumentata tra i primi anni ’90 e la fine del primo decennio del 2000, passando dal 10 al 14% nei maschi e dal 12 al 18% nelle femmine.
Com’è noto, il fumo di sigarette rappresenta a tutto oggi il più consistente fattore di rischio della malattia. Difatti, tale abitudine voluttuaria è riconoscibile nello 85 – 90% di tutti i carcinomi polmonari. Il rischio relativo è, quindi, maggiore di circa quattordici volte nei tabagisti rispetto ai non fumatori e s’incrementa ulteriormente fino a venti volte nei forti fumatori con consumo di oltre venti sigarette il giorno. Contribuiscono al rischio di malattia anche i fattori ambientali, l’inquinamento atmosferico, le esposizioni professionali a sostanze tossiche, come il radon, l’asbesto, i metalli pesanti. I processi cronici sia infiammatori e sia infezioni, come la tubercolosi assumono, inoltre, importanza particolare in tal senso.
Nei riguardi dell’associazione tra l’indice di massa corporea e il rischio di cancro ai polmoni gli studi epidemiologici hanno offerto sino a oggi risultati controversi.
In particolare, Geoffrey C. Kabat della Yeshiva University, Bronx, NY e collaboratori, hanno utilizzato i dati provenienti dallo Women's Health Initiative per studiare l'associazione tra i fattori antropometrici con il rischio di cancro al polmone (Am J Epidemiol. Jul 15, 2008; 168 (2): 158–169).
Negli otto anni di follow-up (1998-2006), accertavano 1.365 casi di cancro al polmone nelle 161.809 donne arruolate allo studio. Utilizzando modelli proporzionali di Cox per stimare gli hazard ratio aggiustati per le covariate, la BMI basale risultava inversamente associata con il cancro al polmone nelle fumatrici correnti. Il quintile più alto rispetto al più basso esprimeva un hazard ratio (HR) di 0.62 con intervallo di confidenza (IC) 95% pari a 0.42, 0.92. Quando, però, la BMI e la circonferenza vita erano reciprocamente aggiustate, la prima era inversamente associata al rischio del cancro, sia nelle fumatrici attuali e sia nelle ex, con HR pari a 0,40 con IC 95% di 0,22, 0,72 e HR 0.61 e IC 95% 0,40, 0,94 rispettivamente. La circonferenza della vita era, invece, positivamente associata con il rischio con HR pari a 1.56 e IC 95% di 0.91, 2.69 e HR di 1,50 e IC 95% di 0,98, 2,31 rispettivamente. In chi non aveva mai fumato, l’altezza mostrava un'associazione positiva borderline con il cancro del polmone.
Questi risultati suggerivano che nelle fumatrici la BMI era inversamente associata al rischio di cancro al polmone, mentre la circonferenza della vita lo era positivamente.
Gli Autori ribadivano che i punti di forza del loro studio consistevano nel numero relativamente elevato dei casi, nella completezza del follow-up e nelle informazioni dettagliate raccolte nell'intera coorte WHI su una vasta gamma dei potenziali fattori di rischio, compresa la misura basale dell’altezza, del peso e delle circonferenze dell'anca e della vita.
Peraltro, il questionario WHI, richiesto per selezionare uno dei sette livelli di frequenza e della durata del fumo di sigaretta, permetteva una valutazione di una vasta gamma di esposizione al fumo di sigaretta migliorando la capacità di rilevare le associazioni.
Vi era, comunque, un buon numero di limitazioni, soprattutto nelle capacità del questionario WHI a offrire informazioni su alcuni aspetti del comportamento del fumare. Inoltre, i dati su alcune variabili erano disponibili solo per lo studio osservazionale del WHI, come alcune riguardanti il peso corporeo. Infine, un altro importante limite era la mancanza d’informazioni sui tipi istologici del tumore al polmone diagnosticati nelle partecipanti WHI.
Per loro conto, Leung CC dell’University of Hong Kong e collaboratori hanno arruolato dal 2000 al 2003 un gruppo di anziani di età uguale o superiore ai sessantacinque anni, seguendoli in modo prospettico fino al 31 dicembre 2008 (International Journal of Epidemiology 2010;1–9).
Dopo un totale di 423.061 anni-persona di follow-up, si riscontravano 932 decessi per cancro del polmone, 690 per altri tumori legati al tabacco e 1.433 per altre neoplasie non associate al fumo. Dopo aggiustamento per le altre variabili di base, l’indice di massa corporea (BMI) era indipendente e negativamente associato con la morte per cancro ai polmoni, mentre vi era solo un effetto minimo o nullo per le altre neoplasie correlate e per quelle non dovute al fumo. L’obesità con BMI maggio4re o uguale a trenta, con hazard ratio aggiustato (HR) pari a 0,55 e intervallo di confidenza (IC) 95% a 0,38-0,80, era associata, invece, a una riduzione della mortalità per il cancro del polmone, in modo più importante che l'effetto opposto del sottopeso (HR aggiustato, 1.38, 95% IC 1,05-1,79). Gli effetti consistenti della BMI si osservavano dopo stratificazione nei non e mai fumatori e nelle analisi di sensitività, dopo aver escluso i decessi entro i primi tre anni.
In conclusione, in quest’analisi prospettica di coorte l'obesità si associava con una più bassa mortalità per cancro al polmone.
Yang R dell’University of Miami Florida e collaboratori, per chiarire il ruolo dell’obesità o della perdita di peso sulla sopravvivenza del cancro polmonare, hanno utilizzato un set di dati, identificando 76.086 casi di cancro polmonare durante il periodo 1998-2002, di cui 14.751 con obesità e / o perdita di peso (J Surg Res. 2011; 170 (1): e75-83).
Gli Autori, secondo un'analisi univariata e multivariata, esaminavano, quindi, la relazione tra la sopravvivenza e la perdita di peso con l'obesità al momento della diagnosi. Per tutti i pazienti con cancro del polmone il MST (Median survival time) era 8.7 mesi. Quelli che si presentavano con la perdita di peso (15.8%) avevano un MST più breve rispetto agli altri (6.4 rispetto a 9.2 mesi, p <0,001) e in modo significativo per tutte le fasi e i sottotipi istologici. Al contrario, i pazienti inizialmente obesi (5.4%) avevano un MST maggiore rispetto a quelli non obesi (13.0 contro 8.6 mesi, p <0,001). Questo risultato era, inoltre, significativo per tutte le fasi e i sottotipi istologici. Peraltro, l'analisi multivariata rivelava che nel cancro del polmone l'assenza della perdita del peso era un indicatore positivo e indipendente del miglioramento della sopravvivenza (HR = 0,087, p <0,001). L’assenza dell’obesità, invece, era un predittivo indipendente del peggioramento (HR = 1,16, p <0,001).
In conclusione, nella sopravvivenza del cancro del polmone si dimostravano una relazione inversa con la perdita del peso al momento della presentazione e un potenziale effetto protettivo dell'obesità. Questo dato era probabilmente dovuto alle maggiori riserve fisiologiche che offriva l’obesità, tanto da poter prolungare la vita per rallentare la progressione della cachessia neoplastica.
Llewellyn Smith del National Cancer Institute e collaboratori hanno prospetticamente esaminato l'associazione tra la BMI e il rischio di cancro al polmone in 448.732 uomini e donne di età dai cinquanta ai settantuno anni, reclutati durante il National Institutes of Health–AARP Diet and Health Study 1995-1996 (J Natl Cancer Inst 2012;104:778–789).
Gli Autori in un follow-up medio di 9,7 anni sino al 2006 hanno, così, identificato 9.437 carcinomi polmonari, di cui 415 nei non fumatori. Gli hazard ratio (HR) e gli intervalli di confidenza (IC) al 95% con aggiustamento per i fattori di rischio di cancro ai polmoni, compreso lo stato di fumatore, erano stimati attraverso i modelli di regressione multivariata di Cox a rischi proporzionali.
Nel corso del periodo di follow-up, il tasso grezzo d’incidenza del cancro al polmone era 233 per 100.000 anni-persona tra gli uomini e 192 tra le donne. La BMI risultava inversamente associata con il rischio di cancro tra gli uomini e tra le donne (BMI ≥35 vs 22,5-24,99 kg / m2: HR = 0.81, IC 95% = 0,70-0,94 e HR = 0.73, IC 95% = 0,61-0,87, rispettivamente). L'associazione inversa era limitata ai fumatori attuali ed ex ed era più forte dopo l'aggiustamento per il fumo. Tra i fumatori l'associazione inversa persisteva anche dopo la fine della stratificazione dello stato di fumatore e del tempo trascorso dallo smettere di fumare. Tale dato dipendeva anche dal numero di sigarette fumate il giorno. L’analisi di sensibilità non sosteneva la possibilità che l'associazione inversa fosse dovuta a una malattia prevalente non diagnosticata.
In conclusione, i risultati suggerivano che nei fumatori correnti ed ex una BMI più elevata potesse essere associata a un ridotto rischio di cancro ai polmoni.
Yang Y della Soochow University, Suzhou, People's Republic of China e collaboratori, ritenendo poco chiara e inconcludente la relazione tra l'obesità e l'incidenza di cancro, hanno condotto una metanalisi degli studi pubblicati dal 1966 a dicembre 2011 per fornire una valutazione quantitativa di quest’associazione (Int J Cancer. 2013 Mar 1;132 (5):1162-9).
Gli Autori hanno, così, esaminato un totale di trentuno articoli.
Nel complesso il peso corporeo in eccesso, definito da un indice di massa corporea (BMI) maggiore o uguale a 25 kg / m2, si rilevava inversamente associato con l'incidenza del cancro al polmone per un rischio relativo (RR) di 0.79 con intervallo di confidenza (IC) 95% di 0,73-0,85, rispetto al peso normale, definito da un BMI = 18,5-24,9 kg / m2. L'associazione non cambiava con la stratificazione per sesso, popolazione, disegno dello studio e metodo di misurazione della BMI. Tuttavia, nella stratificazione per l’abitudine al fumo l'associazione inversa tra peso corporeo in eccesso e l'incidenza del cancro al polmone si rafforzava nei fumatori correnti (RR = 0,63, IC 95%: 0,57-0,70) e che avevano smesso (RR = 0,73, IC 95%: 0,58-0,91). Pure nei non fumatori l'associazione era statisticamente significativa (RR = 0,83, IC 95%: 0,70-0,98), anche se il collegamento era indebolito in una certa misura. Inoltre, le analisi stratificate dimostravano che il peso corporeo in eccesso risultava inversamente associato con il carcinoma a cellule squamose (RR = 0.68, IC 95%: 0,58-0,80) e con l'adenocarcinoma (RR = 0,79, IC 95%: 0,65-0,96). Non si riscontrava, invece, un legame statisticamente significativo tra il peso corporeo in eccesso e il carcinoma a piccole cellule (RR = 0,99, IC 95%: 0,66-1,48).
I risultati di questa metanalisi indicavano, in definitiva, che il sovrappeso e l'obesità erano fattori protettivi contro il cancro al polmone, in particolare negli ex fumatori e quelli attuali.
Peter Mazzone della Cleveland Clinic, Ohio e collaboratori, per determinare l’esistenza di differenze del profilo dei piccoli metaboliti nel siero dei pazienti con NSCLC (non-small cell lung cancer) allo stadio I-III rispetto ai controlli, hanno selezionato due verifiche per ogni malato attraverso propensione di corrispondenza che includeva l’età, il sesso, l’abitudine al fumo, la BPCO, il DM e i lipidi (Chest. 2014;146 (4_MeetingAbstracts):587°).
L'analisi coinvolgeva novantaquattro pazienti affetti da cancro del polmone e 188 soggetti di controllo senza la malattia. L'età media era di sessantotto anni e il 48% dei pazienti era di sesso femminile. I malati di cancro erano un po' più anziani (68,7 vs 66,2, p = 0,013) e tutte le altre variabili corrispondenti non erano significativamente differenti.
I ricercatori hanno identificato 534 metaboliti comuni a entrambi i gruppi, trovando differenze significative nella concentrazione di 149 di essi tra il gruppo cancro e quello di controllo (valori q <0,05).
In particolare, si rilevavano riduzioni dei composti fenolici, elevata attività della via di transulfurazione ed elevazione degli acidi grassi. Un modello che conteneva trentasei metaboliti aveva un’AUC di 0,837 (sensibilità 70,2%, specificità 89,5%), come distinzione tra il cancro del polmone e il controllo.
In conclusione, i pazienti con stadio I-III del tumore polmonare non a piccole cellule avevano differenti profili dei metaboliti nel siero, rispetto ai controlli appaiati. Tutto ciò portava a considerare che i pazienti con cancro del polmone avrebbero avuto processi metabolici modificati e che queste informazioni avrebbero potuto portare allo sviluppo di un biomarcatore diagnostico per il rilievo precoce della malattia come avviene per il diabete e altre malattie croniche.
Sovrappeso e cancro d’interesse urologico
Come riportato dall’AIRTUM (Associazione italiana dei registri tumori), il carcinoma renale, anche se considerato malattia rara, rappresenta circa il 2-3% delle neoplasie maligne e le stime d’incidenza del 2012 in Italia riportavano circa 10.000 nuovi casi, di cui l’85% del tipo istologico a cellule renali. Esso, comunque, in virtù del miglioramento dei sistemi di diagnosi, è in continua crescita con circa il 25-30% dei casi con metastasi. Lo stadio della malattia alla diagnosi fornisce il principale fattore prognostico con una sopravvivenza a cinque anni dal 71 al 97% per le neoplasie proprie del rene, dal 20 al 53% per quelle localmente avanzate, mentre non supera il 10% per quelle allo stadio IV.
In Europa il RCC (renal cell carcinoma) rappresenta il 3% di tutte le neoplasie dell’adulto con la più alta incidenza nei Paesi occidentali. Il suo incremento generale d’incidenza è tra i sessanta e i settanta anni e con un rapporto uomo-donna di 2 : 1. È pari al 2% per decade ed è ascrivibile principalmente alla diagnosi delle neoplasie di piccole dimensioni.
In Italia i valori si pongono ai limiti alti, rappresentando il 2.9% del totale delle diagnosi di cancro, con il 3.5% nei maschi e il 2.3% nelle femmine. La mortalità, in riduzione al contrario dell’incidenza, corrisponde al 2,5% del totale dei decessi per neoplasia nei maschi e all’1,8% nelle femmine.
I principali fattori di rischio della malattia consistono nel fumo, nell’obesità, nell’ipertensione e nella malattia cistica renale.
Si riscontra anche nel 50-80% dei soggetti affetti dalla malattia autosomica dominante di von Hippel-Lindeau.
Gli alti livelli dell’insulina possono giocare un ruolo nello sviluppo della malattia.
Per quanto riportato il cancro del rene costituisce un problema crescente in tutto il mondo. In particolare, l'obesità e l'ipertensione, come detto in precedenza, possono essere coinvolti. Gli studi, però, che hanno esaminato questi due possibili fattori di rischio, sono stati oggetto di diverse limitazioni, tra cui i piccoli campioni, il breve follow-up e la mancanza di misure della pressione sanguigna. Inoltre, pochi studi hanno esaminato l'obesità e l'ipertensione insieme.
Si stima, in definitiva, che circa il 50% della popolazione sopra i cinquanta anni di età possa presentare almeno una massa renale che nella maggior parte dei casi può riferirsi a un cancro renale primitivo RCC (renal cell carcinoma). Circa il 25-30% dei pazienti con RCC sono asintomatici e la diagnosi è fatta quasi sempre in occasione di un esame per immagini, come un’ecografia, una tomografia computerizzata, o una risonanza magnetica. La maggior parte delle lesioni occasionali può essere tranquillamente diagnosticata come cisti benigne semplici, mentre per alcune lesioni complesse s’impongono indagini aggiuntive.
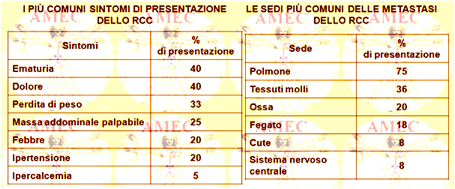
Le presentazioni più comuni dello RCC sono l’ematuria, il dolore al fianco, la perdita di peso, la presenza di massa ai fianchi, la febbre, l’ipertensione e l’ipercalcemia. Può anche comparire un varicocele. Solo il 10% dei pazienti presenta la classica triade del dolore al fianco, ematuria e una massa ai fianchi. La presenza di questa classica triade spesso può indicare una fase più avanzata della malattia. I segni e sintomi dello RCC possono essere simili a quelli di molte altre malattie, rendendo la diagnosi differenziale potenzialmente difficile con la nefrolitiasi, le infezioni del tratto urinario, le cisti renali, o l’ascesso renale.
L’immunoterapia con citochine ha rappresentato per molti anni il trattamento di scelta del carcinoma renale, peraltro scarsamente sensibile alla chemioterapia e all’ormonoterapia. Pur tuttavia, i risultati complessivi di efficacia sono stati scarsi e gravati anche da una pesante tossicità. Negli ultimi anni la comprensione dei meccanismi molecolari implicati nella patogenesi di questa malattia, con l’individuazione degli utili bersagli terapeutici, ha permesso i maggiori progressi del trattamento medico.
Ildaphonse G del Regional Cancer Center, Trivandrum, Kerala, India e collaboratori hanno condotto un'analisi di sintesi quantitativa per valutare in rapporto alla BMI (indice di massa corporea) l’evidenza negli uomini del rischio del cancro del rene (Asian Pac J Cancer Prev. 2009; 10 (2):279-86).
Gli studi inclusi nella loro revisione erano tutti quelli di coorte e caso-controllo con informazioni sul rischio del cancro renale associato con l'obesità / sovrappeso, pubblicati tra il 1992 e il 2008.
In primo luogo gli Autori hanno stimato il rischio associato all’aumento di una unità di BMI (1 kg / m2) per i singoli studi che avevano utilizzato il modello logit-lineare. S’includevano, così, ventisette studi di cui tredici di coorte e quattordici caso-controllo che riportavano negli uomini il rischio di cancro del rene in base alla BMI. La forza dell’associazione era quasi simile nella maggior parte degli studi di coorte. Il rischio relativo (RR) variava per ogni unità di aumento della BMI da 1,04 a 1,06. In uno studio lo RR era 1.08. Non c'era eterogeneità tra gli studi (p = 0,164). Il rischio complessivo sulla base degli studi di coorte era 1,05 (IC 95% = 1,04-1,06) per ogni unità di aumento della BMI.
Gli Autori affermavano, quindi, che la loro analisi confermava l'evidenza del rischio di cancro del rene con una maggiore BMI negli uomini e che l'obesità poteva essere responsabile, almeno in parte, dei tassi in aumento della sua incidenza.
Per loro conto, Mathew A del Regional Cancer Center, Trivandrum, Kerala, India e collaboratori hanno condotto un'analisi di sintesi quantitativa per valutare se l'obesità potesse comportare un relativo maggiore rischio nelle donne rispetto agli uomini (Asian Pac J Cancer Prev. 2009; 10 (3):471-8).
Gli studi inclusi in questa revisione quantitativa erano tutti di coorte e caso-controllo pubblicati tra il 1992 e il 2008 con informazioni sul rischio del cancro renale associato con l'obesità / sovrappeso. In primo luogo gli Autori stimavano il rischio associato a un aumento di un’unità di BMI (1 kg / m2) per i singoli studi che avevano utilizzato il modello logit-lineare. Selezionavano, quindi, ventotto studi, quindici di coorte e tredici caso-controllo, che fornivano nelle donne il rischio del cancro del rene in base alla BMI. Il rischio relativo (RR) con significatività statistica per ogni unità di aumento della BMI in diversi studi di coorte variava da 1,04 a 1,12. Il rischio complessivo negli studi di coorte per ogni unità di aumento della BMI era, invece, 1.06 (IC 95% = 1,05-1,07). Inoltre, il rischio complessivo tra tutti gli studi che avevano registrato l'associazione in ambo i sessi, era leggermente superiore nelle donne.
In conclusione, secondo gli Autori la loro analisi faceva rilevare nel caso dell’obesità un rischio del cancro del rene più elevato nelle donne rispetto agli uomini.
William T. Lowrance del Memorial Sloan-Kettering Cancer Center, NY, USA e collaboratori, in ragione della diffusione epidemica dell'obesità che avrebbe potuto contribuire alla crescente incidenza del carcinoma renale, hanno voluto studiare in una coorte contemporanea l'associazione tra l’indice di massa corporea (BMI) e l’istologia dello RCC (renal cell carcinoma), migliorando anche il rapporto tra l’obesità con i diversi sottotipi istologici della neoplasia (BJU International, 2010; 105 (1): 16).
Gli Autori identificavano, quindi, 1.640 pazienti con tumori corticali renali in fase di asportazione chirurgica presso il loro istituto dal gennaio 2000 al dicembre 2007 e che avevano la registrazione della loro BMI.
Scoprivano che l’88 per cento aveva un tumore maligno e il 61 per cento di questi era un RCC a cellule chiare. Il restante 12 per cento aveva, invece, un tumore benigno. Utilizzavano, quindi, modelli di regressione logistica multivariata per verificare l'associazione tra la BMI con l’istologia dello RCC.
La media (range interquartile) della BMI era 28 (25-32) kg / m2 e il 38% dei pazienti era classificato obeso per una BMI maggiore di 30 kg / m2. Dopo aggiustamento per le dimensioni del tumore, per l’età, per il sesso, per il punteggio della società americana degli anestesisti, per la velocità di filtrazione glomerulare stimata, per l’ipertensione, per il diabete mellito e per il fumo, la BMI era significativamente associata con l’istologia a cellule chiare. Gli Odds Ratio erano 1,04 per ogni unità di BMI (intervallo di confidenza (IC) 95%: 1,02-1,06, P <0.001) e 1.48, quando si confrontavano gli obesi con i pazienti normopeso (IC 95%: 1,19-1,84, P <0.001). Nel sottogruppo dei pazienti con RCC, esclusi quelli con i tumori corticali renali benigni, la BMI era ancora un predittivo indipendente dell’istologia a cellule chiare (odds ratio 1,04, IC 95%: 1,02-1,06, P = 0.001).
In conclusione, questi risultati suggerivano agli Autori che nei pazienti con un tumore corticale renale la BMI era un predittivo indipendente dell’istologia a cellule chiare, la forma più comune di cancro a cellule renali. Essere obeso significava avere una probabilità del 48 per cento più elevata di sviluppare un carcinoma renale a cellule chiare (RCC), rispetto ai pazienti con un indice di massa corporea (BMI) inferiore ai trenta e che le probabilità aumentavano del 4 per cento per ogni punto in più.
I ricercatori suggerivano anche che nei pazienti obesi quest’associazione sarebbe potuta essere sostenuta dai cambiamenti ormonali, o dalla diminuzione della funzione immunitaria, dall’ipertensione, oppure dal diabete.
Bassel G Bachir della Duke University Medical Center, NC, USA e collaboratori hanno rivisto la letteratura riguardante l'influenza dell'obesità sul cancro della prostata, del rene e della vescica (Urologic Oncology (Impact Factor: 3.65). 12/2010; 29 (5):476-86).
L'obesità sembrava, invero, poter promuovere un aumento del rischio di cancro alla prostata aggressivo (CaP), possibilmente correlato in parte a un bias di rilevazione trovato negli uomini obesi. I risultati peggiori chirurgici e dei trattamenti di radiazione negli obesi sembravano, invero, legati non solo alle sfide tecniche, ma anche alle differenze inerenti alla biologia del tumore e alle presentazioni di una malattia più aggressiva.
Si osservava una forte associazione tra l’obesità e l’aumento del rischio di carcinoma a cellule renali (RCC). Gli Autori a proposito dei loro risultati commentavano che la nefrectomia radicale laparoscopica negli obesi era ormai considerata come fattibile e che poteva essere la tecnica con una morbilità inferiore, rispetto alla chirurgia aperta. Era anche interessante notare che l'obesità poteva conferire dopo la nefrectomia un miglioramento della sopravvivenza specifica per il carcinoma renale localizzato.
L'influenza dell’indice di massa corporea (BMI) sul cancro della vescica, peraltro, era poco conosciuta. Nei pazienti obesi, comunque, s’incontravano maggiori rischi perioperatori a seguito della cistectomia.
In definitiva, gli Autori concludevano che la relazione tra obesità e tumore maligno genito-urinario era davvero impressionante.
Kristen M. Sanfilippo della Washington University, St. Louis e collaboratori, considerando l’aumento dell’incidenza del cancro del rene a livello globale per ragioni non completamente chiare, ma che potevano riguardare soprattutto l'obesità e l'ipertensione, hanno analizzato per 10,8 anni le relazioni longitudinali tra queste malattie in 156.774 partecipanti al Women’s Health Initiative clinical trials and observational studies (Hypertension 2014;63:934-941).
Gli Autori esaminavano, così, per oltre venticinque anni anche l'effetto della pressione sanguigna (BP) sui decessi per cancro del rene tra i 353.340 uomini del MRFIT (Multiple Risk Factor Intervention Trial). Le donne erano classificate in sei gruppi in ragione della pressione arteriosa sistolica (SBP) da meno di 120 a più di 160 mm Hg. L’indice di massa corporea era classificato secondo i criteri standard. Nelle analisi aggiustate per età, il rischio del cancro del rene aumentava tra le categorie di SBP con P <0.0001 e quelle d’indice di massa corporea con P sempre <0.0001. Nei modelli proporzionali di Cox aggiustati, entrambi i livelli di SBP e d’indice di massa corporea erano predittivi del cancro del rene. Nel campione MRFIT tra i 353.340 partecipanti dello screening di età compresa tra i trentacinque e i cinquantasette anni, si rilevavano dopo una media di venticinque anni di follow-up 906 morti attribuite al cancro del rene. Il rischio di morte per cancro del rene era aumentato in modo dose-risposta con l'aumentare della SBP con un hazard ratio pari a 1.87 per una SBP maggiore di 160, rispetto a quella inferiore a 120 mmHg (intervallo di confidenza 95%: 1,38-2,53). Il rischio era aumentato tra i fumatori di sigarette.
In conclusione, sulla base dei loro risultati gli Autori ponevano l’accento sulla necessità di successive ricerche utili a determinare la base fisiopatologica dei rapporti tra BP e il più alto il rischio del cancro del rene e anche la possibile influenza favorevole alla salute in tal senso delle terapie antipertensive specifiche per l'ipertensione.
Gli Autori, peraltro, facevano notare che l'obesità, in effetti, si associava a un aumento della velocità di filtrazione glomerulare e all’aumento del flusso plasmatico renale. Tutto ciò, quindi, poteva rendere i reni più suscettibili al danno e alla carcinogenesi.
D’altro verso, nei pazienti con ipertensione la sovraregolazione dei fattori inducibili l’ipossia renale cronica poteva svolgere, a sua volta, un ruolo nell’oncogenesi.
Peraltro, sia l'obesità e sia ipertensione si associavano con lo stress ossidativo e la perossidazione lipidica. Tutto ciò poteva avere un ruolo nella patogenesi del cancro del rene. Inoltre, l'obesità poteva aumentare il rischio del cancro attraverso l'aumento dei livelli dell’insulina e della crescita del fattore I insulinosimile.
In ultimo, poteva essere coinvolta anche la malattia renale cronica.
A proposito delle linee guida fornite dallo NCCN (National Comprehensive Cancer Network) e dall’AUA (American Urological Association) sulla sorveglianza dopo l'intervento chirurgico per RCC (renal cell carcinoma) Suzanne B. Stewart della Mayo Clinic, Rochester, MN e collaboratori hanno valutato la loro capacità di poter catturare le recidive del tumore (Urological Association, Orlando, FL, May 16-21, 2014).
Gli Autori hanno, in effetti, dimostrato che seguendo le correnti linee guida di sorveglianza, poteva mancare alla diagnosi ben un terzo di tutte le recidive degli RCC, ossia dal 31,8% al 33,1%.
Si valutavano per questo 3.651 pazienti sottoposti a intervento chirurgico per M0 RCC tra il 1970 e il 2008. I pazienti erano stratificati come AUA (American Urological Association) a basso rischio (pT1Nx-0), dopo nefrectomia parziale (LR-parziale) o radicale (LR-radicali) o come moderato / alto rischio (M / HR; pT2-4Nx-0 / pTanyN1). Le linee guida erano valutate calcolando la percentuale delle recidive rilevate, seguendo le raccomandazioni 2013 e 2014 NCCN e AUA. Erano anche analizzati e confrontati i relativi costi assistenziali.
Dopo un follow-up di 9,0 anni (range interquartile, 5,7-14,4), 1.088 pazienti (29,8%) sperimentavano una recidiva. Il 35,9% di questi, in numero di 390, era rilevato utilizzando le raccomandazioni NCCN 2013, mentre 742 (68,2%) quelle 2014. Il 66,9% delle recidive, in numero di 728, era rilevato con le raccomandazioni AUA. Tutti i protocolli perdevano il maggior numero di recidive nell'addome e tra i pazienti pT1Nx-0. Per catturare il 95% delle recidive era richiesta una sorveglianza di quindici anni per le LR-parziali, ventuno per le LR-radicali e quattordici per i pazienti / HR M. I costi di sorveglianza sanitaria per paziente LR-parziale erano $ 1,228.79 con le NCCN 2013, $ 2,131.52 con le 2.014 e $ 1,738.31 con le linee guida AUA. Tuttavia, se il 95% delle recidive LR-parziali fosse stato diagnosticato, i costi sarebbero ammontati a $ 9,856.82.
In conclusione, se seguite scrupolosamente, le linee guida 2014 NCCN e AUA facevano perdere circa un terzo delle recidive degli RCC. Ciò portava gli Autori a stimolare migliori algoritmi di sorveglianza a beneficio dei pazienti.
Sovrappeso dell'adolescente e rischio di tumore futuro uroteliale
Adi Leiba della Tel Aviv University, Israel e collaboratori hanno valutato l'associazione tra l’obesità adolescenziale e il rischio futuro di cancro uroteliale (Obesity Volume 20, Issue 12, pages 2445–2450, December 2012).
Gli Autori per questo si sono serviti dei dati medici di 1.110.835 adolescenti israeliani pervenuti tra il 1967 e il 2005 all'esame d’idoneità al servizio militare, collegandoli al National Cancer Registry. Hanno, quindi, usato il modello di Cox dei rischi proporzionali per stimare gli HR (hazard ratio) aggiustati per le covariate per il tumore uroteliale associato con la BMI, misurata all'età di diciassette anni. Il follow-up medio di 17,6 ± 10,8 anni rifletteva 19.576.635 anni/persona, durante i quali 661 esaminandi sviluppavano il cancro uroteliale della vescica, dell’uretere, o della pelvi renale. La BMI ≥ 85 ° percentile di serie in adolescenza prediceva in modo significativo l’aumento del rischio di cancro con un HR, corretto per anno di nascita, istruzione e religiosità, di 1,42 (intervallo di confidenza 95% (IC), 1,13-1,77, p = 0,002). Risultati simili si osservavano in condizioni di definizione ≥ 25 kg/m2 di sovrappeso (HR = 1,36 (95% IC, 1,08-1,72), p = 0.008). L'incidenza del tumore uroteliale risultava significativamente più bassa nei soggetti più istruiti e tra coloro che avevano frequentato le scuole religiose. I dati del ruolo del sovrappeso in età adolescenziale per lo sviluppo futuro dell’aumentato rischio di tumore uroteliale portavano gli Autori a suggerire un nuovo percorso di prevenzione.
In un successivo studio gli Autori con la stessa metodologia e coorte valutavano anche l'HR del carcinoma renale associato con l'anno di nascita, con l’indice di massa corporea, con l'altezza, con il paese d'origine del padre e con gli indicatori socioeconomici (J Urol. 2013 Jan;189 (1):25-9. doi: 10.1016/j.juro.2012.08.184).
Nel corso del periodo di follow-up di 19.576.635 anni-persona, 274 esaminandi sviluppavano il cancro renale. Un indice di massa corporea superiore a 27,5 kg / m2 conferiva un sostanziale eccesso di rischio, rispetto a quello inferiore a 22,5 kg / m2 (HR 2.43, 95% IC 1,54-3,83, p <0,0001). L’origine asiatica o africana si dimostrava protettiva rispetto a quella europea (origine africana HR 0.67, 95% IC 0,49-0,92).
In conclusione, il sovrappeso nella tarda adolescenza rappresentava un fattore di rischio significativo per il carcinoma a cellule renali. L’origine europea era indipendentemente associata ad aumentato rischio e persisteva tra i nati maschi israeliani.
Aumento del peso corporeo e cancro ovarico
I tumori del tessuto ovarico possono derivare dai tre tipi di cellule dell’organo:
- Le epiteliali, che rivestono l'ovaio,
- Le stromali, che producono gli ormoni,
- Le germinali che diventano ovuli.
Per l’85 - 90 per cento essi sono carcinomi epiteliali.
Nel 2012 il cancro ovarico ha fatto registrare in tutto il mondo circa 239.000 casi, classificandosi in generale come il 18° più comune cancro e il settimo nelle donne. È corrisposto, pertanto, al 4 per cento di tutti i nuovi casi di cancro nelle donne e al 2 per cento del totale.
È un tipo di tumore di solito fatale ed è risultato l’ottava causa più comune di morte per cancro nelle donne di tutto il mondo e la quattordicesima in assoluto. I Paesi ad alto reddito hanno presentato un tasso d’incidenza maggiore rispetto a quelli a medio e basso. Nell’Europa centrale e orientale i tassi d’incidenza standardizzati per età sono variati da più degli undici per 100.000 donne, mentre in alcune parti dell'Africa sono stati meno del cinque per 100.000.

Gli studi finora condotti non hanno indicato le cause precise del cancro ovarico, ma solo i fattori che ne aumentano il rischio.
Si tratta in genere di un tumore maggiormente frequente dopo i quaranta anni con picchi massimi tra i cinquanta e i sessantanove anni.
Le caratteristiche di maturazione sessuale e dei relativi eventi nel corso della vita della donna assumono una particolare influenza.
Difatti, un’alterazione genetica che si tramanda nelle generazioni con la mutazione, l'età, l’assetto ormonale, un menarca precoce, una menopausa tardiva, la nulliparità e una prima gravidanza tardiva ne aumentano il rischio. Azione protettiva hanno, invece, le gravidanze, il menarca tardivo, l’allattamento al seno e la menopausa precoce. I contraccettivi orali hanno, peraltro, dimostrato protezione contro questo tipo di tumore.
Rivestono anche importanza i fattori ambientali, come l’esposizione al talco e all’amianto e così pure i fattori dietetici, come la dieta ipercalorica e ricca di grassi, e l’assunzione di alcol.
Il cancro dell'ovaio spesso non offre una particolare sintomatologia nelle fasi iniziali, per cui la diagnosi avviene spesso quando la malattia è particolarmente avanzata. Il tasso di sopravvivenza a cinque anni varia da circa il trenta al 50 per cento.
La maggior parte dei tumori ovarici si verifica spontaneamente e il 5-10 per cento di essi si sviluppa in conformità a una predisposizione genetica che coinvolge i geni disfunzionali BRCA1 o BRCA2, producendo i carcinomi con la peggiore prognosi.
Pur tuttavia, alla base della sua insorgenza sono state formulate diverse, ma non definitive ipotesi. La ripetuta rottura e riparazione della superficie ovarica a seguito dei numerosi cicli ovulatori potrebbe, invero, rappresentare un motivo di stimolo alla proliferazione dell'epitelio con aumento delle probabilità delle mutazioni spontanee. Oppure dopo l'ovulazione alcune cellule possono rimanere all'interno del tessuto connettivo circostante dell'ovaio con formazione di cisti d’inclusione. In tal caso, le cellule epiteliali sono sottoposte a un microambiente proinfiammatorio con danni al DNA e aumento del rischio del cancro.
Il Collaborative Group on Epidemiological Studies of Ovarian Cancer, considerando la scarsezza delle pubblicazioni e l’incoerenza dei loro risultati sulla rilevanza dell’altezza e dell’indice di massa corporea delle donne nei riguardi del rischio di sviluppare il cancro ovarico, ha messo insieme gli elementi delle evidenze della letteratura mondiale (PLoS medicine, 2012. 9 (4): p. e1001200).
Gli studiosi hanno, così, raccolto dati individuali su 25.157 donne con tumore ovarico e su 81.311 donne senza cancro ovarico provenienti da quarantasette studi epidemiologici, controllandoli e analizzandoli a livello centrale. Il rischio relativo aggiustato di cancro ovarico era calcolato per l’altezza e l’indice di massa corporea.
Questo rischio aumentava significativamente con i parametri individuati, tranne che negli studi che utilizzavano i controlli ospedalieri. Per gli altri disegni di studio il rischio relativo del cancro ovarico per 5 cm di aumento dell’altezza era 1.07 (intervallo di confidenza [IC] 95%= 1,05-1,09; p <0,001). Questo rapporto non variava significativamente con l’età delle donne, l'anno di nascita, l’educazione, l’età del menarca, la parità, lo stato menopausale, il fumo, il consumo di alcol, un possibile precedente intervento d’isterectomia, la familiarità di primo grado di cancro ovarico o della mammella, l'uso di contraccettivi orali, o della terapia ormonale in menopausa.
Nei risultati vi era per l’indice di massa corporea una significativa eterogeneità (p <0,001) tra le donne che avevano fatto sempre uso della terapia ormonale in menopausa e chi non era mai ricorsa a essa. Per gli altri undici fattori precedentemente elencati non vi erano problemi. Il rischio relativo di cancro alle ovaie per 5 kg / m2 di aumento dell'indice di massa corporea era 1.10 (IC 95%, 1,07-1,13; p <0,001) nelle non-utenti e 0,95 (IC 95%, 0,92-0,99; p = 0,02) nelle utilizzatrici della terapia ormonale.
In conclusione, il cancro ovarico era associato con l'altezza e con l’indice di massa corporea di coloro che non ricorrevano alla terapia ormonale. Nei paesi ad alto reddito sia l’altezza sia l’indice di massa corporea segnavano un aumento nelle coorti di nascita che dimostravano un aumento della malattia. Pertanto, se tutti gli altri fattori significativi del rischio fossero rimasti costanti, si sarebbe dovuto attribuire l’aumento del 3% nell'incidenza del cancro ovarico per ogni decennio alla crescita dell’altezza e del peso corporeo.
L’Ovarian Cancer SLR 2013 ha identificato diciotto recenti lavori per un totale di ventisei studi, compresi quelli del SER con associazione tra l’eccesso di peso e il cancro dell’ovaio. Nel complesso, di ventitré studi che riportavano le stime d’incidenza del cancro ovarico tra i gruppi di BMI più alti rispetto ai più bassi, tre dimostravano una significativa associazione positiva, nove una non significativa positiva e undici una non significativa inversa. Due studi con stime di mortalità mostravano un'associazione positiva, anche se solo in uno era significativa. Uno studio non riportava una stima del rischio. Venticinque studi erano inclusi nella meta-analisi di dose-risposta per l’indice di massa corporea e il cancro ovarico (n = 15 899) e si osservava un 6 per cento di aumento del rischio per ogni cinque unità di BMI. Tutto ciò era statisticamente significativo [(RR 1.06 (IC 95% 1,02-1,11)]. Pur tuttavia, c'era evidenza di una sostanziale eterogeneità (I2 = 55%), in gran parte a causa delle dimensioni dell’effetto. L'analisi non lineare mostrava un aumento statisticamente significativo del rischio del cancro ovarico per indice di massa corporea superiore a 28,4 kg / m2 (The World Cancer Research Fund / American Institute for Cancer Research. Continuous Update Project Report. Food, Nutrition, Physical Activity, and the Prevention of Ovarian Cancer 2014).
Particolare interesse ha suscitato la ricerca di Laura Rosano del Regina Elena Cancer Institute e collaboratori per le possibili ripercussioni rivoluzionarie sul trattamento del tumore ovarico (Cancer Res canres. 3133.2013; 6, 2014).
Gli studiosi facevano rilevare che l’elevata mortalità dell’EOC (epithelial ovarian cancer) era, in effetti, causata principalmente dall’indisponibilità delle terapie efficaci.
Nel carcinoma ovarico potevano, così, verificare che l’endotelina, legandosi al suo recettore e alla proteina adattatrice beta-arrestina, attivava altre cascate di segnale e s’integrava con la via molecolare di Wnt/beta-catenina, responsabile dell’insorgere della chemioresistenza. Il macitentan, inibitore dell’endotelina e approvato nella cura dell’ipertensione polmonare, dimostrava di agire sui tumori ovarici chemioresistenti. Questo farmaco, in effetti, bloccando i recettori A e B dell’endotelina, espressi sulla parete dei vasi sanguigni e anche sulle cellule tumorali, riusciva a inibire sia la formazione delle metastasi sia l’insorgenza della chemioresistenza. Contemporaneamente impediva la formazione di nuovi vasi che alimentavano il tumore.
Makowski L dell’University of North Carolina – USA e collaboratori, rilevando che l’obesità si associava a un aumento del rischio e ai risultati peggiori per il cancro ovarico, hanno esaminato i suoi effetti sulla progressione di questa neoplasia in un modello di topo (Gynecol Oncol. 2014 Apr;133 (1):90-7).
Gli Autori hanno, così, utilizzato un modello unico di cancro ovarico sieroso del topo con delezione, in particolare, dei geni oncosoppressori BRCA1 e p53, e inattivazione delle proteine del retinoblastoma (Rb) nelle cellule epiteliali di superficie ovariche adulte, mediante iniezione di un vettore adenovirale che esprimeva il Cre (AdCre) nella borsa cavità ovarica delle femmine adulte (modello murino KPB). I topi KPB erano stati sottoposti a una dieta HFD (high fat diet) con 60% di calorie derivate dai grassi contro una dieta LFD (low fat diet) con il 10% di calorie dai grassi per imitare l'obesità indotta dall’alimentazione. I tumori erano isolati a sei mesi dopo l'iniezione e valutati istologicamente AdCre. Era effettuata una profilazione dell’espressione genica e metabolomica non mirata per valutare le differenze nei tumori ovarici dei topi KPB obesi rispetto non-obesi.
Al sacrificio, i topi obesi HFD avevano un peso due volte superiore di quelli LFD (51gr rispetto ai 31gr p = 0,0003). I tumori ovarici erano significativamente più grandi negli obesi rispetto ai controlli (3,7 cm2 rispetto a 1,2 cm2, p = 0,0065). L’espressione genica e i profili metabolomici indicavano differenze statisticamente significative tra i tumori ovarici degli obesi contro i controlli, tra cui percorsi metabolicamente rilevanti.
Il Collaborative Group on Epidemiological Studies of Ovarian Cancer, che ha coinvolto per iniziativa dell'Università di Oxford oltre 100 ricercatori di tutto il mondo, ha voluto valutare gli effetti della terapia ormonale sul rischio di cancro ovarico (The Lancet, 2015 DOI: 10.1016/S0140-6736 (14)61687-1).
Gli Autori facevano notare che la metà degli studi epidemiologici con informazioni sulla terapia ormonale in menopausa e rischio di cancro ovarico rimaneva inedita così che alcuni studi retrospettivi potevano essere viziati da una partecipazione selettiva o da un richiamo. Venivano, così, analizzati centralmente cinquantadue studi epidemiologici.
I risultati erano riferibili a studi prospettici in America settentrionale, Europa e Australia con follow-up su 12.110 donne in postmenopausa, di cui il 55%, pari a 6.601, aveva usato la terapia ormonale e aveva sviluppato il cancro ovarico. Tra le donne registrate come utenti correnti, il rischio aumentava anche con meno di cinque anni di utilizzo (RR= 1·43, IC 95%= 1·31-1·56; p <0·0001). Combinando l'uso corrente o recente, qualsiasi durata, ma con interruzione di meno di cinque anni prima della diagnosi, si otteneva un RR di 1·37 (IC 95% 1·29-1·46; p <0·0001). Questo rischio era simile negli studi prospettici europei e americani e per preparati del solo estrogeno ed estrogeno-progestinici, ma differiva per i quattro principali tipi di tumore (eterogeneità p <0·0001). Si rilevava un molto più cospicuo aumento solo per i due tipi più comuni, il sieroso (RR= 1·53, IC 95%= 1·40-1·66; p <0·0001) e l’endometrioide (1·42, 1·20-1·67; p <0·0001). Il rischio diminuiva con la cessazione dell’uso, anche se circa dieci anni dopo l'interruzione di lunga durata della terapia ormonale c'era ancora un eccesso di tumori sierosi o endometrioidi (RR= 1·25, IC 95%= 1·07-1·46, p = 0·005). Inoltre, l'aumento del rischio era indipendente dall'età d’inizio della cura, dalla massa corporea, dall'uso di contraccettivi, del tabacco o degli alcolici, da una precedente isterectomia o da una storia familiare di tumore al seno o alle ovaie.
In conclusione, secondo gli Autori l'aumento del rischio sarebbe potuto essere in gran parte o totalmente causale. Se ciò fosse stato, le donne che facevano uso di terapia ormonale per cinque anni dall’età di circa cinquanta avrebbero dovuto avere circa un cancro ovarico in più per 1000 utenti e, se la sua prognosi fosse stata tipica, circa un decesso in più per cancro ovarico per 1.700 utenti.
Eccesso di peso e linfoma
I linfomi fanno parte del più ampio gruppo delle neoplasie dei tessuti ematopoietici e linfoidi. Il termine, usato come riferimento quasi esclusivo alle forme maligne, raggruppa un insieme di tumori del tessuto linfoide rappresentato dai linfociti T e B e dai loro precursori. Le caratteristiche principali sono l’ingrossamento generalmente non doloroso dei linfonodi, la febbre, la sudorazione soprattutto notturna, il prurito, la perdita di peso e l’astenia.
Due sono le principali forme del linfoma: quello di Hodgkin (HL) e quello non-Hodgkin (NHL), che costituisce circa il 90% dei casi e comprende un gran numero di sottotipi. L'Organizzazione Mondiale della Sanità ha inserito in questa categoria anche altre due patologie: il mieloma multiplo e la malattia immunoproliferativa.
I fattori di rischio individuati per il HL sono la famigliarità e l’infezione del virus di Epstein-Barr. Quelli per il NHL, invece, sono le malattie autoimmuni, l'AIDS, l'infezione da virus T-linfotropico dell'uomo, l’uso massiccio di carne, di grassi e di farmaci immunosoppressori e l'esposizione ad alcuni pesticidi. In particolare, si è dimostrato che, rispetto alla popolazione generale, il rischio di NHL è da quattordici a diciannove volte più alto nelle persone con sindrome di Sjogren primaria, sette volte maggiore nei malati di lupus eritematoso sistemico (LES), da due a quattro volte superiore nell’artrite reumatoide, di 2,7 volte più alto nella sclerosi sistemica e da due a sei volte più alto nel morbo celiaco. I sottotipi più spesso associati alle malattie autoimmuni sono il DLBCL (diffuse large B-cell lymphoma) e gli MZL (marginal zone lymphomas). La disregolazione immunitaria è alla base, sia delle malattie autoimmuni e sia dello sviluppo del linfoma. Peraltro, nei pazienti con malattia reumatica infiammatoria il rischio di NHL nei sottotipi di cellule B NHL può essere maggiore nel trattamento con anti (TNF)-α. Infine, il rischio di NHL è di circa otto volte superiore nei pazienti con trapianto d'organo in trattamento con immunosoppressori. Si è dimostrato che questi pazienti, di solito, sviluppano il DLBCL (diffuse large B-cell lymphoma).
Per la diagnosi sono utili analisi di laboratorio, d’imaging e bioptiche di un linfonodo.
Il trattamento comporta in genere una combinazione di terapia chirurgia, chemioterapia e radioterapia.
O. Landgren del Karolinska Hospital and Institutet, Stockholm, Sweden e collaboratori hanno voluto per loro conto, valutare l'impatto della BMI (body mass index) sulla prognosi dei pazienti trattati in un lungo follow-up con la chemioterapia HL (Ann Oncol (May 2005) 16 (5): 838-840).
Gli Autori hanno, così, recuperato nell’ambito del Gruppo di Studio HL di Stoccolma 1973-1994 i dati clinici e biologici provenienti dai pazienti con diagnosi di HL di età maggiore dei sedici anni, trattati con chemioterapia e con follow-up fino al 1o gennaio 2001, o fino al decesso.
La BMI maggiore di trenta permetteva la classificazione dei pazienti obesi, quella da venticinque a trenta di quelli in sovrappeso, quella dai diciotto ai venticinque dei normali e quella inferiore ai diciotto di quelli con sottopeso. I fattori significativi erano poi inclusi nel modello di regressione di Cox multivariato. La CSS (Cause-specific survival) era calcolata dal momento della diagnosi fino al giorno della morte per l’HL o della morte correlata al trattamento. L’OS (Overall survival) era calcolata a partire dal momento della diagnosi fino al giorno della morte, indipendentemente dalla causa.
Cinquantaquattro pazienti, corrispondenti al 22%, erano classificati come obesi o in sovrappeso. Il profilo prognostico variava significativamente (P <0,05) tra i gruppi della BMI, con il miglior profilo prognostico nei pazienti obesi e in sovrappeso. La distribuzione RDI (relative dose intensity) non differiva tra i due gruppi di BMI. Il CSS di cinque anni per i gruppi di BMI era del 100% negli obesi, dell’88% nel sovrappeso e del 75% nei normali e in sottopeso. I pazienti normali e in sottopeso non mostravano differenze per quanto riguardava i CSS. La corrispondente OS a cinque anni per i gruppi BMI era rispettivamente del 100%, del 79% e del 70%. Nelle analisi della regressione uni e multivariata l’indice di massa corporea era indipendente e significativamente associato con i CSS.
In conclusione, secondo gli Autori nella loro serie di pazienti HL trattati con chemioterapia, l'adiposità nell’analisi multivariata si associava sia con un profilo prognostico di rischio significativamente migliore e sia con un CSS più vantaggioso. Questi risultati erano, in effetti, alquanto inaspettati e apparentemente in contrasto con il numero limitato dei rapporti sull'obesità a proposito dei risultati nel cancro della mammella, del colon e in quelli con non HL trattati con chemioterapia.
Kenneth R. Carson della Washington University School of Medicine e collaboratori, ritenendo non chiara l'associazione tra l’indice di massa corporea (BMI) al momento della diagnosi e la sopravvivenza nel DLBCL (diffuse large B-cell lymphoma), la forma più comune di NHL (non-Hodgkin's lymphoma), hanno studiato retrospettivamente 2.534 veterani con affetti da tale malattia tra il primo ottobre 1998 e il 31 dicembre 2008 (J Clin Oncol. Sep 10, 2012; 30 (26): 3217–3222).
Gli Autori hanno, così, utilizzato modelli di Cox per il controllo delle variabili prognostiche correlate alla malattia.
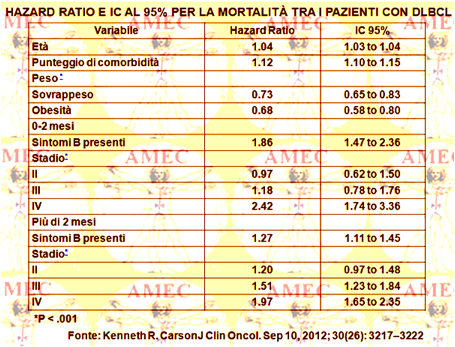
L'età media alla diagnosi era di sessantotto anni con range dai venti ai cento anni. Il 64% dei pazienti era in sovrappeso con BMI dai venticinque a trenta, oppure obeso con BMI uguale o superiore ai trenta. Rispetto agli altri gruppi di BMI, gli obesi erano significativamente più giovani, avevano significativamente meno sintomi B e una tendenza della malattia verso gli stadi bassi. L’analisi di Cox mostrava una riduzione della mortalità nei pazienti in sovrappeso e in quelli obesi (sovrappeso: hazard ratio [HR], 0.73; IC 95%= 65-, 83; obesi: HR, 0.68; IC 95%= 0,58-0,80), rispetto ai pazienti normopeso con BMI dai 18,5 ai venticinque. Il trattamento durante l'era del rituximab riduceva il rischio di morte, senza alterare l'associazione tra la BMI e la sopravvivenza. Le patologie connesse con la perdita del peso si verificavano nel 29% dei pazienti con dati di peso di un anno prima della diagnosi. L’analisi di Cox, basata sulla BMI a un anno prima della diagnosi, continuava a dimostrare una riduzione del rischio di morte nei pazienti in sovrappeso e con obesità.
In conclusione, il sovrappeso o l’obesità al momento della diagnosi di DLBCL si associava a un miglioramento della sopravvivenza globale.
Chia-Ching J. Wang dell'UCSF, San Francisco, CA, USA e collaboratori hanno svolto uno studio per individuare i nuovi fattori di rischio per il PCNSL (primary central nervous system lymphoma) a spiegazione del suo continuo aumento d’incidenza tra le popolazioni immunocompetenti non-infette da HIV (Human Immunodeficiency Virus).
In effetti, il PCNSL, la cui incidenza è notevolmente aumentata nel corso degli ultimi tre decenni, riconosce nella malattia avanzata da HIV e nelle condizioni d’immunodeficienza congenite e iatrogene i ben stabiliti fattori di rischio. Pur tuttavia, essa continua a salire tra i pazienti più anziani oltre i sessanta anni d’età, non chiaramente immunodepressi nella stragrande maggioranza dei casi (Blood:November 15, 2013; 122 (21).
Gli Autori hanno, così, raggruppato una coorte di settantadue pazienti HIV-negativi con diagnosi di linfoma CNS primario e secondario che avevano ricevuto una valutazione di follow-up ambulatoriale presso l'Università della California a San Francisco tra il 2009-2013, abbinandoli a controlli per fascia d'età, sesso e razza. Hanno, quindi, considerato la positività HBcAb al basale, come prima infezione del virus, e quella HBsAg sempre al basale, come prova della cronica. L’indice di massa corporea (BMI) era classificato come normale e di riferimento se inferiore a venticinque, come sovrappeso se da venticinque a trenta e come obesità se uguale o superiore a trenta.
Tra sessantaquattro pazienti alla diagnosi di età media di 61,5 anni con PCNSL, ventotto, pari al 44%, erano di sesso maschile, il 69% di razza caucasica. Peraltro, sei, pari al 10%, decedevano durante il periodo di follow-up e sette, pari all’11%, avevano un coinvolgimento intraoculare. L’aumento della BMI e l’infezione da HBV cronica o di prima istanza risultavano associati in modo indipendente a un aumentato rischio di PCNSL. L’infezione da HBV presentava un OR = 14,8 (5,0-44) e un p <0,0001. Per la BMI tra obesità vs normalità l’OR era uguale a 2,8 (1,2-6,5), con p per trend = 0,04. Non c'era evidenza di confondimento e d’interazione statistica tra il HBV e la BMI (p = 0,72). La positività HCV era valutata, ma l'analisi era limitata giacché solo tre pazienti avevano anticorpi positivi anti-HCV e uno anche anti HBV. I risultati di coinvolgimento intraoculare delle analisi descrittive fornivano alcune prove del fatto che questi pazienti PCNSL avevano più probabilità di essere nati in un paese con moderata alta prevalenza di HBV / (x2 p = 0,006). I pazienti PCNSL obesi erano statisticamente e significativamente più giovani (età media cinquantaquattro anni), rispetto ad altri pazienti in sovrappeso (età media 64,5, normale 63). Era interessante notare che i pazienti asiatici erano più giovani per età media di cinquantasette anni, rispetto ai Caucasici con età media di sessantadue. Inoltre, i pazienti con epatite B erano più anziani per età media di sessantasei anni, rispetto ai non Hep B con età media di cinquantasei, ma la differenza non era statisticamente significativa. Tutti i pazienti erano trattati con chemioterapia sistemica a base di methotrexate anti PCNSL ad alte dosi. Peraltro, 37 (58%) erano stati definiti in remissione completa al termine del periodo di follow-up. Per i pazienti PCNSL a cellule B che erano stati trattati con methotrexate ad alto dosaggio (n = 55), se obesi, avevano migliorato la sopravvivenza libera da progressione (PFS), rispetto ai non-obesi (P <0.04; HR 0,3). Al contrario, una storia d’infezione da epatite B risultava associata a una più breve sopravvivenza libera da progressione (P = 0.04; HR 2.7). In particolare, in quest’analisi i fattori di rischio apparenti dell’obesità e / o dell’epatite B incidevano per circa la metà dei cinquantacinque pazienti PCNSL senza l’infezione da HIV.
In conclusione, gli Autori, nel ritenere il loro studio come primo rapporto sull’associazione tra obesità, infezione di epatite B e PCNSL, consideravano i risultati in parte utili per spiegare la crescente incidenza di questo sottotipo di NHL. Tutto ciò nell’ipotesi che, sia l'infezione da epatite B e sia l'obesità potendo promuovere per ciascun proprio conto stati infiammatori, avrebbero potuto contribuire alla linfomagenesi nel sistema nervoso centrale.
L’International Lymphoma Epidemiology Consortium NHL Subtypes Project offre fino a oggi la più grande e completa verifica dei potenziali fattori di rischio per una vasta gamma dei sottotipi comuni e rari dello NHL Le analisi contribuiscono, invero, alla comprensione della natura multifattoriale delle varie eziologie dei sottotipi per motivare le ipotesi sulle potenziali indagini, per fornire indizi per la prevenzione e per esemplificare i vantaggi della collaborazione consortile internazionale nell’epidemiologia del cancro (J Natl Cancer Inst Monogr. 2014 Aug;2014 (48):1-14).
Castillo JJ del Dana Farber Cancer Institute, Boston e collaboratori, avendo costatato l’assenza di revisione sistematica di una relazione tra l’indice di massa corporea (BMI) e l'incidenza del DLBCL (diffuse large B-cell lymphoma), hanno eseguito una ricerca bibliografica nei meriti (Clin Lymphoma Myeloma Leuk. 2014 Apr;14 (2):122-30).
La metanalisi, utilizzando il modello degli effetti casuali, voleva quantificare il RR (relative risk) d’incidenza del DLBCL nelle persone in sovrappeso o obese, rispetto agli individui di peso normale. Si eseguivano, quindi, le analisi secondo il disegno dello studio, il sesso e la regione geografica. Il sovrappeso era definito da una BMI dai venticinque ai 29,9 kg / m2 e l'obesità dai 30 kg / m2. Utilizzando, di poi, un modello di massima verosimiglianza senza restrizioni, si effettuava una metaregressione per valutare l'associazione lineare tra la BMI e la probabilità di DLBCL.
Erano inclusi nello studio sei trial caso-controllo e dieci di coorte. Il RR di DLBCL nel sovrappeso era 1.14 con intervallo di confidenza (IC) 95% 1,04-1,24 e p = .004. Negli obesi il RR era 1.29, lo IC 95% era 1,16-1,43 e il P <.001. Il RR del DLBCL negli uomini in sovrappeso era 1,22 e nelle donne 1,27. Nei soggetti in sovrappeso entrambi gli studi prospettici e caso-controllo mostravano un RR di 1.13. Il RR del DLBCL negli uomini e nelle donne obese era 1,40 e 1,34, rispettivamente. Nei soggetti obesi, il RR negli studi prospettici era 1,25 e in quelli caso-controllo 1,33. L’analisi di metaregressione mostrava un aumento del 14% dell'incidenza DLBCL per ogni 10 kg / m2 di aumento del BMI.
In conclusione, un aumento del BMI si associava con una maggiore RR di DLBCL, indipendentemente dal sesso. Inoltre, sembrava che ci fosse un’associazione lineare tra il BMI e l'incidenza del DLBCL.
Eccesso di peso e ALL (leucemia linfoblastica acuta)
In pediatrica l’ALL (acute lymphoblastic leukemia), se associata all'obesità al momento della diagnosi, corrisponde in genere a un aumento del rischio di recidiva e a un’EFS più povera (event-free survival). Si è anche dimostrato che la durata dell'obesità durante i mesi intensivi iniziali di chemioterapia tende a predire indipendentemente l’EFS. Nei moderni regimi di trattamento dei malati, comunque, la risposta alla chemioterapia, misurata dall’induzione finale della MRD (minimal residual disease) nel midollo osseo, è tra i più forti predittori dell’EFS.
Ethier MC dell’Hospital for Sick Children, Toronto, ON, Canada e collaboratori hanno inteso precisare il rapporto tra l’obesità e il cambiamento di peso durante l’induzione, l’EFS (event-free survival) e l’OS (overall survival) nei bambini con ALL (acute lymphoblastic leukemia).
I partecipanti erano bambini dai due ai diciotto anni con ALL diagnosticata tra il gennaio 2001 e il settembre 2006. Si completavano analisi di regressione univariata e multiple. S’includeva un totale di 238 bambini di cui 21 (8,8%) erano obesi al momento della diagnosi.
Gli obesi, rispetto ai normopeso, avevano a cinque anni un EFS (62,2 ± 12,1% vs 83,6 ± 2,6%; p = 0,02) e un OS inferiori (80,7 ± 8,7% vs 92,9 ± 1,9%; p = 0.005). All'analisi univariata l'aumento di peso durante l'induzione si associava con un migliore EFS (hazard ratio [HR]= 0.89, intervallo di confidenza [IC] 95%= 0,82-0,97; p= 0,009) e OS (HR= 0.81, IC 95%= 0,74-0,90; p= <0.0001).
In conclusione, i pazienti pediatrici obesi con ALL avevano una sopravvivenza inferiore, mentre il maggiore peso durante l'induzione poteva essere associato a una migliore sopravvivenza. Secondo gli Autori, quindi, scaturiva dal loro studio la raccomandazione di gestire in modo aggressivo le cause di perdita di peso durante l'induzione in questi malati (Leuk Lymphoma. 2012 Sep;53 (9):1677-81).
Etan Orgel dell’University of Southern California, Los Angeles e collaboratori hanno valutato l'influenza dell’indice di massa corporea sul rischio d’induzione finale positiva della MRD (minimal residual disease) nel midollo osseo (Blood. 2014; 124 (26): 3932– 3938).
Gli Autori anticipavano che tale studio traeva motivo dal fatto che l'obesità si associava con gli EFS (event-free survival) più poveri nell’ALL (acute lymphoblastic leukemia). La persistenza della MRD nel midollo osseo, misurata dalla MDF (multidimensional flow cytometry), si offriva come precoce indicatore prognostico chiave ed era fortemente associata con l’EFS. S’ipotizzava, quindi, che l'obesità durante l’induzione potesse avere un ruolo positivo con lo stato finale della MRD (> 0,01%).
Si analizzavano, così, le MDF d’induzione finale dei campioni di midollo osseo da una coorte di 198 bambini con nuova diagnosi di BP-ALL (B-precursor ALL) e trattati con regimi d’induzione del Children’s Oncology Group. Si valutava l'influenza dell’indice di massa corporea sul rischio d’induzione positivo finale per la MRD nel midollo osseo. Nella coorte di BP-ALL, trenta bambini (il 15,2%) erano in sovrappeso e 41 (il 20,7%) erano obesi al momento della diagnosi. L’obesità durante l'induzione era associata, indipendentemente dai predittori consolidati di risposta al trattamento, con il rischio significativamente maggiore di MRD persistente (odds ratio= 2,57; intervallo di confidenza 95%= 1,19-5,54; P 5 .016). L’obesità e il sovrappeso erano associati con una povera EFS, indipendentemente dall’induzione finale della MRD (P= 5.012).
In conclusione, i bambini obesi con nuova diagnosi di BP-ALL erano ad aumentato rischio d’induzione positiva MRD finale e di EFS più povera.
Quale approccio al trattamento oncologico dell’anziano?
L’anziano, a differenza del giovane, presenta un quadro clinico complesso con tutta una serie di comorbidità che vanno dall’ipertensione, al diabete, all’insufficienza renale e alle cardiovasculopatie di ogni genere. In tali casi l’efficacia delle terapie deve misurarsi con il fattore età con tutte le problematiche che un anziano di oltre sessantacinque anni può presentare. Peraltro, l’organismo senile è più sensibile e suscettibile agli eventi avversi dei farmaci, soprattutto di quelli oncologici. Peraltro, l’età è stata ormai indicata dagli studi clinici come il fattore di rischio più alto per l’insorgenza del cancro. Questo dato acquista, inoltre, maggiore consistenza in rapporto all’invecchiamento progressivo demografico, principalmente delle arre più sviluppate del pianeta. In aggiunta, i maggiori consumatori di farmaci sono le persone anziane che raggiungono la cifra di oltre dodici milioni nel nostro Paese. Sono, in effetti, i pazienti più fragili che molto più spesso devono assumere i farmaci e spesso combinandoli insieme perché colpiti da più patologie croniche. Per tutto ciò l’approccio al trattamento del cancro deve essere sempre più mirato e non trascurare la presenza delle comorbidità che comunemente si accompagnano all'età avanzata. Bisogna individuare e perseguire obiettivi di efficacia della terapia e anche del mantenimento della qualità di vita.
È quanto ha particolarmente affermato Guido Francini, Direttore dell’Oncologia Medica dell’Università di Siena nel “1st Rome International Meeting on Geriatric Oncology – RIMOG”, tenutosi a Roma il 4 e 5 dicembre 2014 e da lui presieduto.
A tale proposito, torna utile ricordare che Handforth C del Leeds Teaching Hospitals NHS Trust e collaboratori, proprio ricordando che la fragilità rappresenta uno stato di particolare vulnerabilità per la scarsa capacità omeostasica a seguito di un evento stressante, come la chemioterapia o la chirurgia del cancro, hanno eseguito una metanalisi nei meriti (Ann Oncol. 2014 Nov 17. pii: mdu540).
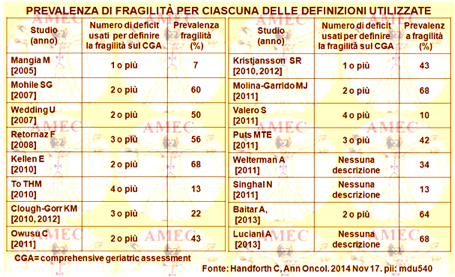
Gli Autori, in effetti, facevano notare che una migliore conoscenza dell'epidemiologia della fragilità sarebbe potuta essere d’aiuto nel guidare una strategia globale di cura del cancro nelle persone anziane. L'obiettivo della revisione era, quindi, quella di stabilire la prevalenza e gli esiti della fragilità e pre-fragilità nei pazienti oncologici anziani.
A tal fine, si consideravano gli studi osservazionali in letteratura dal primo gennaio 1996 al 30 giugno 2013, che riportassero i dati sulla prevalenza e / o risultati di fragilità nei pazienti oncologici anziani con qualunque fase del tumore maligno solido o ematologico. Gli esiti primari erano la prevalenza della fragilità, gli effetti collaterali correlati al trattamento, l'ospedalizzazione e la mortalità non pianificata. Il rischio di bias era valutato utilizzando la lista di controllo di Newcastle-Ottawa.
I dati di venti studi con valutazione di 2.916 partecipanti erano, così, inclusi. La prevalenza media riportata di fragilità e pre-fragilità era del 42% (range 6% -86%) e del 43% (range 13% -79%) rispettivamente. Una media del 32% (range 11% -78%) dei pazienti era classificata come idonea. La fragilità era indipendentemente associata a un aumento della mortalità per tutte le cause [hazard ratio aggiustato di cinque anni (HR)= 1,87, intervallo di confidenza (IC) 95%= 1,36-2,57]. C'era evidenza di aumento del rischio di mortalità postoperatoria, sia per la fragilità (HR aggiustato di trenta giorni = 2.67, IC 95%= 1,08-6,62) e sia per la pre-fragilità (HR aggiustato= 2,33, IC 95%= 1,20-4,52). Le complicazioni del trattamento erano più frequenti nei soggetti con fragilità, comprese l'intolleranza al trattamento del cancro (odds ratio aggiustato= 4,86, IC 95%= 2,19-10,78) e le complicanze postoperatorie (HR aggiustato di trenta giorni= 3,19, IC 95%= 1,68-6,04).
In conclusione, più della metà degli anziani affetti da cancro avevano pre-fragilità o fragilità ed erano ad aumentato rischio d’intolleranza chemioterapica, di complicanze post-operatorie e di mortalità. Questi risultati inducevano gli Autori a incoraggiare la valutazione di routine della fragilità nei pazienti oncologici anziani per guidare le decisioni di trattamento e lo sviluppo dei servizi multidisciplinari di oncologia geriatrica.
Sotto altro aspetto Nathalie Vande Walle1 dell’University Hospitals Leuven, Belgium e collaboratori hanno voluto valutare la ricorrenza di cadute entro due o tre mesi dopo la decisione del trattamento oncologico e di identificarne i predittivi durante il follow-up (BMC Geriatrics 2014, 14:135).
Gli Autori traevano incentivo del lavoro dalla costatazione che nella popolazione anziana le cadute rappresentavano un problema comune e una delle principali cause di morbilità, di mortalità e di declino funzionale. L'eziologia, spesso multifattoriale rendeva, peraltro, difficile l'identificazione dei predittivi essenziali per le misure di prevenzione. Nonostante questa consapevolezza, però, i dati di tale condizione nei malati anziani di cancro erano rilevati limitati.
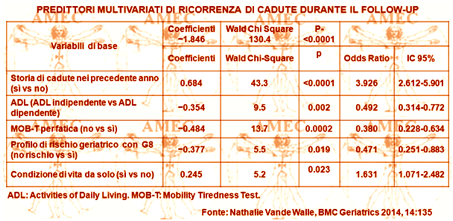
S’includevano, quindi, nello studio i pazienti più anziani di settanta anni o oltre da sottoporre a un trattamento antineoplastico. Al basale, tutti i pazienti erano sottoposti a uno screening geriatrico con G8 e Flemish Triage Risk Screening Tool, seguito da una valutazione geriatrica comprendente le condizioni di vita, le ADL (activities of daily living), le IADL (instrumental activities of daily living), la storia di cadute negli ultimi dodici mesi, la fatica, la cognizione, la depressione, la nutrizione, le comorbilità e la politerapia.
Si utilizzavano questionari per raccogliere i dati nel follow-up di 2-3 mesi. Si eseguivano analisi univariate e multivariate per identificare i predittivi delle cadute da una o più durante tutto il follow-up.
Al basale il 31,5% dei 937 pazienti, corrispondente come numero a 295, riportava almeno una caduta negli ultimi dodici mesi. Il 29,5%, corrispondenti a ottantotto, sosteneva di aver subito un grave infortunio. Durante il follow-up dei 2-3 mesi, 142 pazienti, corrispondenti al 17,6%, cadevano e di essi il 51,4% più di una volta. Il 17,6%, inoltre, segnalava un grave infortunio. Al basale la storia di cadute negli ultimi dodici mesi (OR = 3,926), di fatica (OR = 0.380), di dipendenza ADL (OR = 0,492), del profilo di rischio geriatrico dal G8 (OR = 0,471) e della condizione di vita solitaria (OR = 1.631) si dimostravano predittori indipendenti delle cadute da una a molte, entro i 2-3 mesi dalla decisione del trattamento antineoplastico.
In conclusione, le cadute si rivelavano un problema grave tra i pazienti oncologici anziani. Gli Autori affermavano che i dati di screening e della valutazione geriatrica potevano, però, permettere di identificare i casi a rischio. In effetti, un paziente con associati fattori di rischio di cadute avrebbe dovuto ottenere un'aggiuntiva valutazione e altri interventi per prevenire gli incidenti di caduta potenzialmente pregiudizievoli.
Geriatric assessment e approccio multidisciplinare nell’anziano oncologico
Il rapporto dell'Osservatorio Nazionale Screening del Ministero della Salute riporta che nel 2013 si sono sottoposte ben oltre 5.200.000 cittadini agli screening garantiti dal Servizio sanitario Nazionale contro i tumori e ossia a quello della mammella, del colon-retto e cervicale. Più precisamente 1.940.996 hanno eseguito lo screening colon-rettale, 1.784.177 quello mammografico e 1.533.412 quello cervicale, risultando il primo in un’avanzata significativa crescita, anche nell’Italia meridionale. Tuttavia, lo screening mammografico ha segnato per l’Italia settentrionale una percentuale di partecipazione superiore al 90%, mentre per il meridione si è fermata sotto il 40%. Stessa tendenza si è segnata per il cancro colon-rettale, mentre per quello cervicale le differenze sono state inferiori.
Peraltro, le aspettative di sopravvivenza dei malati oncologici si stanno modificando, soprattutto da quando si è aperta una nuova era nel trattamento con l’adozione dell’immunotarget-terapia, la cura che utilizza il sistema immunitario per combattere le cellule tumorali. Il modello della sua applicazione è stato fornito dal melanoma e, come approccio rivoluzionario, si sta diffondendo con successo a molti altri tipi di tumore, come quello del polmone e del rene.
I risultati principali del primo sondaggio AIOM (Associazione Italiana di Oncologia Medica), peraltro, sull’immuno-oncologia dello scorso gennaio, che ha coinvolto sia i pazienti sia i clinici, hanno rilevato che l’appropriata definizione del farmaco immuno-oncologico era conosciuta da oltre il 90% dei pazienti con melanoma in trattamento e che l’80% lo riteneva efficace e più tollerato rispetto agli altri agenti antineoplastici. Pur tuttavia, il 98% era consapevole degli effetti collaterali, anche se differenti dai chemioterapici tradizionali.
Roy S. Herbst dell’Yale School of Medicine, Connecticut - USA e collaboratori hanno inteso valutare la sicurezza, l'attività e i biomarcatori dell’inibizione PD-L1 tramite l’anticorpo MPDL3280A umanizzato, progettato con la bioingeneria (Nature Vol. 515, P 563–567 27 November 2014).
Gli Autori riportavano a base delle loro intenzioni di ricerca il concetto che lo sviluppo del cancro umano è un processo a più fasi, caratterizzato dall'accumulo di alterazioni genetiche ed epigenetiche che guidano o riflettono la progressione del tumore. Questi cambiamenti distinguono le cellule tumorali dalle loro controparti normali, permettendo il riconoscimento di estraneità del neoplasma da parte del sistema immune. Tuttavia, i tumori sono raramente respinti spontaneamente, riflettendo la loro capacità di mantenere un microambiente immunosoppressivo. Il PD-L1 (Programmed death-ligand 1), chiamato anche B7-H1 o CD274, che si esprime in molti tumori e cellule immunitarie, svolge un ruolo importante nel bloccare il ciclo immunitario del cancro legandosi alla PD- 1 e alla B7.1 (CD80), entrambi regolatori negativi dell'attivazione dei T-linfociti. Il legame della PD-L1 ai suoi recettori sopprime la migrazione dei linfociti T, la proliferazione e la secrezione dei mediatori citotossici e limita la morte delle cellule tumorali. L'asse PD-L1-PD-1 protegge l'ospite dalle cellule iperattive T -effector non solo del cancro, ma anche durante l’infezione microbica. Il blocco della PD-L1 dovrebbe, pertanto, migliorare l'immunità antitumorale, pur sapendo ancora poco circa i fattori predittivi di efficacia. Qui si dimostra che per diversi tipi di cancro, le risposte (come valutato da criteri di valutazione della risposta nei tumori solidi, versione 1.1) sono state osservate nei pazienti con tumori che esprimono alti livelli di PD-L1, soprattutto quando PD-L1 è stata espressa dal tumore infiltrante immune cellule. Inoltre, le risposte sono state associate con il tipo di T-helper 1 (TH1), l'espressione genica e del CTLA4 e l'assenza di fractalkine (CX3CL1) in campioni tumorali di base. L’insieme di questi dati suggerisce che il MPDL3280A è più efficace nei pazienti con preesistente immunità, è soppresso dal PD-L1 ed è rinvigorito dal trattamento anticorpale.
Dal loro canto, Decoster L della Vrije Universiteit Brussel e collaboratori, insistendo sulla proposta d’identificare quei pazienti oncologici anziani che avevano bisogno di GA (geriatric assessment) e di approccio multidisciplinare, hanno voluto aggiornare le raccomandazioni SIOG (International Society of Geriatric Oncology) 2.005 sull'uso degli strumenti di screening (Ann Oncol. 2015 Feb;26 (2):288-300).
Si è, quindi, predisposto un gruppo di lavoro SIOG per esaminare, interpretare e discutere le prove sull'uso di strumenti di screening nei pazienti oncologici anziani con l’emanazione di una dichiarazione di consenso al loro utilizzo.
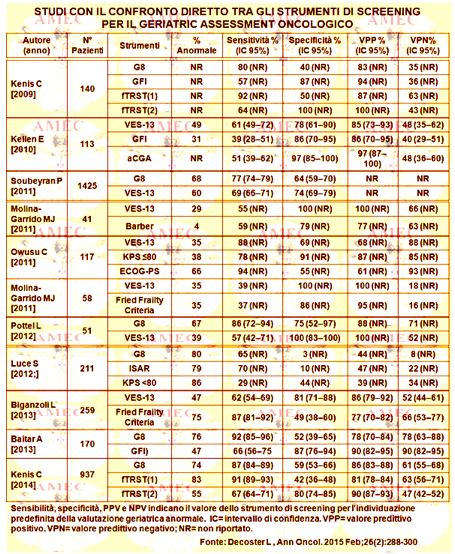
Gli Autori identificavano, quindi, quarantaquattro studi che riportavano l'utilizzo di diciassette diversi strumenti di screening nei pazienti oncologici anziani. Gli strumenti più studiati erano il G8, la versione fiamminga del fTRST (Triage Risk Screening Tool) e il VES-13 (Vulnerable Elders Survey-13). In tutti gli studi la più alta sensibilità si osservava per il G8, il fTRST, l’Oncogeriatric screen, lo Study of Osteoporotic Fractures, l’Eastern Cooperative Oncology Group-Performance Status, il SAOP (Senior Adult Oncology Program) 2 screening e il Gerhematolim. In undici confronti diretti per la rilevazione dei problemi su un GA completo, il G8 era quello altrettanto o più sensibile degli altri strumenti in tutti e sei i confronti, mentre i risultati erano misti per il VES-13 in sette confronti. Inoltre, diversi strumenti dimostravano associazioni con misure di esito, tra cui il G8 e il VES-13.
In conclusione, gli strumenti di screening non sostituivano il GA, ma erano raccomandati in una pratica impegnata al fine di identificare quei pazienti che avevano bisogno di una piena GA. In caso di risultati anomali, lo screening avrebbe dovuto far seguito al GA e guidare gli interventi multidisciplinari. Erano, comunque, disponibili numerosi strumenti con prestazioni diverse per i vari parametri, tra cui la sensibilità per affrontare la necessità dei successivi GA. Gli Autori, peraltro, consideravano necessarie successive ricerche concentrate sulla capacità degli strumenti di screening per costruire percorsi clinici e per prevedere diversi parametri di risultato.
