Breve storia della metformina (glucophage)
La storia delle biguanidi risalirebbe al medioevo europeo, quando la capraggine o galega officinalis, pianta della famiglia delle leguminose di sapore amaro, impiegata per l’ingrasso dei terreni e per la pastura delle bestie, era utilizzata per contrastare la poliuria del diabete. A partire dalla guanidina, principio attivo di questa pianta, negli anni ’20 dello scorso secolo sono derivati farmaci con proprietà antidiabetiche e negli anni ’50 la fenformina e la metformina, unico derivato guanidinico prescritto attualmente in più di novanta paesi. Nel 1975 questa composto chimico è stato approvato in Europa per il trattamento del diabete e nel 1995 negli Stati Uniti e il suo profilo di sicurezza si è dimostrato probabilmente superiore a quello osservato per gli altri farmaci insulino-sensibilizzanti. Oggi giorno in Europa è il secondo antidiabetico orale più prescritto, essendo usato nel 40% dei casi in monoterapia e nel rimanente sessanta in associazione con le sulfoniluree.
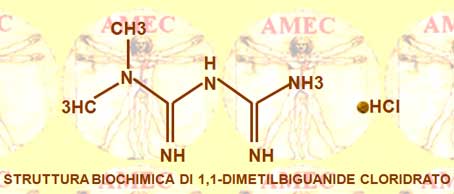
La metformina, originariamente commercializzata come glucofage, è, quindi, un antidiabetico orale della classe delle biguanidi. È il farmaco di prima scelta per il trattamento del diabete di tipo 2, ma attualmente è consigliato anche in soggetti in sovrappeso e obesi con funzione renale normale. Per problemi di sicurezza il suo uso nel diabete gestazionale è limitato. È utilizzato anche nel trattamento della sindrome dell'ovaio policistico ed è stato studiato per altre malattie in cui la resistenza all'insulina può costituire un fattore importante. A tuttora, è considerato l'unico antidiabetico con dimostrate proprietà di prevenire le complicanze cardiovascolari del diabete. Contribuisce a ridurre i livelli delle LDL colesterolo e dei trigliceridi e non provoca aumento del peso corporeo. Dal 2010 è inserito nella Lista del Modello Organizzativo della Sanità tra i farmaci essenziali, insieme alla glibenclamide. Può provocare disturbi gastrointestinali e anche ipoglicemia. Somministrato impropriamente e in eccesso, può essere anche causa di acidosi lattica. Riconosciuto, come detto, nel 1920 per la proprietà di ridurre lo zucchero nel sangue, ha trovato il suo vero interesse nel 1940, divenendo, dopo molte segnalazioni sulle sue proprietà, l’antidiabetico più diffusamente prescritto nel mondo.
La metformina (dimethylbiguanide) si è, quindi, dimostrata un efficace farmaco antidiabetico orale che diminuisce la produzione di glucosio epatico. Il farmaco aumenta anche l’assorbimento del glucosio periferico nei muscoli scheletrici e, in definitiva, il suo approccio fisiopatologico selettivo è legato all’effetto sulla resistenza all'insulina. Peraltro, ha molteplici vantaggi biologici, tra cui l’effetto antiaggregante piastrinico. Riduce, difatti, il tasso di formazione degli AGE (advanced glycation end products) e diminuisce le reazioni ossidative cellulari. C'è anche una dimostrabile azione antiossidante che spiega il suo favorevole effetto protettivo vascolare.
Meccanismo d’azione della metformina (glucophage)
La metformina, cardine della terapia per il diabete mellito per molti anni, ha presentato, tuttavia, aspetti meccanicistici d'azione mal definiti. I recenti progressi avrebbero, comunque, rivelato, anche un promettente ruolo nella ricomposizione metabolica cellulare, oltre alla sua azione ipoglicemizzante. Questo dato può, di certo, aiutare a sviluppare nuovi e promettenti usi di trattamento medico. In effetti, il meccanismo focale di azione della metformina risiede nell'alterazione del metabolismo energetico della cellula. Essa, contrastando l'azione del glucagone, esercita, di fatto, il suo prevalente effetto ipoglicemizzante attenuando la gluconeogenesi epatica. L'inibizione del complesso I mitocondriale risulta in risposta al glucagone nel difetto di segnale dello cAMP e della proteinchinasi A. La stimolazione della proteinchinasi 5'-AMPK attivata, anche se indispensabile per l'effetto ipoglicemizzante della metformina, conferisce la sensibilità all'insulina, principalmente modulando il metabolismo lipidico. La metformina potrebbe, così, influenzare anche la tumorigenesi, sia indirettamente attraverso la riduzione sistematica dei livelli dell’insulina e sia direttamente attraverso l'induzione dello stress energetico.
In definitiva, il principale meccanismo d’azione antidiabetico della metformina consiste nell'inibizione della gluconeogenesi epatica, la via metabolica che permette la sintesi del glucosio nel digiuno o in caso di un’intensa attività fisica per garantirne l'adeguato apporto a tutti i tessuti, compreso il cervello che lo utilizza come fonte energetica primaria. A tale proposito, è bene ricordare che i principali substrati per la gluconeogenesi sono: l'acido lattico, gli amminoacidi glucogenetici, il piruvato e il glicerolo. Il primo è derivato dalla glicolisi anaerobica, i secondi dall'alimentazione o dalla degradazione delle proteine strutturali e i terzi dall'idrolisi dei trigliceridi. La gluconeogenesi, peraltro, che si compie per circa il 90% nel fegato e per il 10% nei reni, non rappresenta il semplice processo inverso della glicolisi poiché vi sono altri quattro specifici passaggi per effetto della piruvato carbossilasi, della PEPCK (Phosphoenolpyruvate carboxykinase), della fruttosio-1,6-bisfosfatasi e della G6Pase (Glucose-6-phosphatase). Il diabetico, per effetto dell'insulino-resistenza, presenta un'attività gluconeogenica che è fortemente stimolata e ottiene un vantaggio reale in caso di una sua inibizione con consequenziale riduzione della glicemia.
La metformina interviene positivamente in quest’azione inibitoria, prevalentemente tramite l'attivazione dell'AMPK, che nella forma attivata catalizza la fosforilazione della serina 171 del CRTC2 (Creb Regulated Transcription Coactivator 2), il quale, una volta fosforilato, è reso inattivo e, quindi, degradato. Il CRTC2, attivo con la serina in 171 non fosforilata, trasloca a livello nucleare e si associa al fattore CREB (cAMP-Response Element-Binding Protein) e alla CBP (CREB Binding Protein) in un complesso che attiva l'espressione genica del PGC-1α (Peroxisome Proliferator-Activated Receptor ϒ Coactivator 1α) e degli enzimi gluconeogenici. Il PGC-1α è, di fatto, un coattivatore trascrizionale interagente con un ampio numero di fattori di trascrizione del metabolismo glucidico e lipidico nelle risposte di adattamento alle basse temperature e nella biogenesi mitocondriale. Il glucagone attiva nel fegato la PGC-1 e favorisce, a sua volta, l'espressione di un ampio numero di fattori di trascrizione, tra cui l'Hepatic Nuclear Factor-4-α e il FOXO1 (Forkhead box protein O1), che legano i promotori dei geni della PEPCK e della G6Pase, stimolandone l'espressione. L’AMPK nel fegato inibisce, a sua volta, questi processi attraverso la fosforilazione del CRTC2, che, una volta fosforilato, è sequestrato a livello del citosol. Peraltro, l'AMPK catalizza nel muscolo la fosforilazione diretta dei residui della treonina 177 e della serina 538 della PGC-1α, determinandone l’attivazione e l'espressione delle GLUT-4 con il consequenziale assorbimento del glucosio e la riduzione della glicemia.
In ultima analisi, la metformina, attivando indirettamente l'AMPK, determina, come detto, il blocco della gluconeogenesi epatica. In presenza d’insulino-resistenza, però, la fosforilazione promossa dall'AMPK è compromessa perché la CRTC2 è presente nella forma O-glicosilata a livello della serina 171, rimanendo solo la via mediata dalla stimolazione epatica della SIRT1. Quest'ultima è una deacetilasi proporzionalmente correlata alla disponibilità del coenzima NAD+ il cui enzima chiave di biosintesi è il NAMPT (Nicotinamide phosphoribosyltransferase), attivato dall'AMPK. Così che, l'aumentata concentrazione del NAD+, derivata dall'attivazione della NAMPT, viene a stimolare l'attività della deacetilasi SIRT1, a sua volta catalizzante la deacetilazione del CRTC2, permettendo la sua fosforilazione AMPK-mediata. Peraltro, concorre all'inibizione della gluconeogenesi anche il disassemblaggio del complesso CREB-CBP-CRTC2, favorito dall'AMPK in seguito alla sua azione permissiva sulla fosforilazione del CBP a livello della serina in posizione 436, mediante l'attivazione di un'atipica PKCι/λ.
Inoltre, l'AMPK produce il suo effetto inibitorio sulla gluconeogenesi anche tramite la stimolazione dell'espressione genica dell’orphan nuclear receptor SHP, che funge da repressore trascrizionale. Quest’ultimo, infatti, può interagire direttamente con il CREB, impedendo di legarsi con il CRTC2, risultandone, quindi, il blocco della trascrizione degli enzimi chiave della via gluconeogenica.
La metformina può, poi per suo conto, inibire la via gluconeogenica anche attraverso un effetto AMPK-indipendente. Essa, in effetti, bloccando il complesso I della catena respiratoria mitocondriale, assicura l'aumento del rapporto AMP/ATP. L'AMP rappresenta, com’è noto, un potente inibitore della fruttosio-1,6-bisfosfatasi per cui l’aumento della sua concentrazione partecipa sinergicamente con gli altri meccanismi inibitori della gluconeogenesi.
La metformina è solubile in acqua, nel sangue non si lega alle proteine e viene eliminata esclusivamente attraverso il rene. Nei pazienti con funzione renale normale il 90% del farmaco viene escreto entro le dodici ore dalla somministrazione orale e l'emivita plasmatica è di 2-6 ore. Quando la funzione renale diminuisce, l’emivita si prolunga e i livelli sierici di metformina possono aumentare. Pertanto, a causa del rischio dell’acidosi lattica, che comporta una prognosi grave, la dose di metformina dovrebbe essere ridotta in ragione della diminuzione del GFR e il trattamento interrotto in caso d’insufficienza renale grave. La metformina, comunque, non è nefrotossica, ma si potrebbe accumulare in caso di grave insufficienza renale cronica o acuta con conseguente aumento del rischio dell’acidosi lattica. Altre condizioni, come l'insufficienza cardiaca acuta o cronica, la setticemia e le malattie del fegato, potrebbero anche portare all’acidosi lattica, rendendo inadeguato il trattamento con metformina.
È bene, a tale proposito, ricordare che la funzione renale, valutata solo sulla base della creatinina nel plasma, costituisce una regola incerta per la stima del GFR e, quindi, una guida inaffidabile per il dosaggio della metformina. Il GFR, calcolato dalla creatinina plasmatica usando le equazioni convalidate (eGFR), è, invece, considerato un modo più appropriato per valutare la funzione renale ed è stato adottato in diverse linee guida.
Song J della Shandong University, Jinan, Shandong, China e collaboratori, considerando la segnalazione dell’attività della metformina nel ridurre l'accumulo dei lipidi negli adipociti, hanno studiato questo effetto nei riguardi dei macrofagi, studiandone i meccanismi coinvolti (Biochemical and Biophysical Research Communications.2010; 393 (1): 89-94).
Ciò anche in ragione del fatto che l'accumulo dei lipidi nei macrofagi contribuisce allo sviluppo dell’aterosclerosi e che le strategie per evitarlo possono, di certo, avere un potenziale terapeutico di prevenzione e per il trattamento anche delle complicanze cardiovascolari.
Gli Autori osservavano che la metformina riduceva significativamente l’accumulo dei lipidi intracellulare indotto dal PA (palmitic acid) nei macrofagi. Promuoveva l'espressione della CPT-1carnitina I (carnitine palmitoyltransferase I), mentre riduceva quella della FABP4 (acid-binding protein 4), coinvolta nell’accumulo dei lipidi indotto dal PA. La PCR quantitativa in tempo reale dimostrava che il farmaco regolava l'espressione del FABP4 a livello trascrizionale. S’identificava un fattore di trascrizione FOXO1 come regolatore positivo dell’espressione FABP4. L'inibizione dell'espressione FOXO1 con il FOXO1 siRNA riduceva notevolmente quella del FABP4 basale e quella indotta dal PA. La sovra espressione del FOXO1 grezzo e del FOXO1, costruttivamente attivo, aumentava significativamente l’espressione del FABP4, mentre il FOXO1 dominante negativo diminuiva drasticamente l’espressione del FABP4. La metformina riduceva l’espressione del FABP4, promuovendo l’esclusione nucleare del FOXO1 e inibendone consequenzialmente l'attività.
In conclusione, nel loro insieme questi risultati suggerivano agli Autori che la metformina riduceva l'accumulo dei lipidi nei macrofagi reprimendo la trascrizione FABP4, mediata dal FOXO1. In tal modo, la metformina poteva essere considerata con un ruolo protettivo contro l'accumulo dei lipidi nei macrofagi, servendo anche come agente terapeutico per la prevenzione e il trattamento dell’aterosclerosi nella sindrome metabolica.
Benoit Viollet dell’INSERM, Paris, France e collaboratori hanno riportato in una loro pubblicazione i dati relativi ai notevoli sforzi compiuti dal 1950 per meglio comprendere i meccanismi cellulari e molecolari di azione di metformina (Clin Sci (Lond). 2012 Mar;122 (6):253-70).
Gli Autori ribadivano che l'effetto principale di questo farmaco della famiglia delle biguanidi era rivolto a diminuire acutamente la produzione epatica del glucosio, soprattutto attraverso un'inibizione lieve e transitoria del complesso I della catena respiratoria mitocondriale. Inoltre, la riduzione conseguente dello stato energetico epatico attivando l’AMPK (AMP-activated protein kinase), un sensore metabolico cellulare, forniva un meccanismo generalmente accettato per l'azione della metformina sulla gluconeogenesi epatica.

La dimostrazione che la catena respiratoria complessa I e non l’AMPK, era l'obiettivo primario della metformina era recentemente rafforzata con la dimostrazione che l'effetto metabolico del farmaco era conservato nei topi con deficit specifico dell’AMPK epatico.

Oltre al suo effetto sul metabolismo del glucosio, si era dimostrato anche che la metformina ripristinava la funzione ovarica nel PCOS (polycystic ovary syndrome), riduceva le probabilità di fegato grasso e abbassava le complicanze microvascolari e macrovascolari associate al T2D. Il suo utilizzo era, quindi, suggerito come trattamento adiuvante per il cancro o il diabete gestazionale e per la prevenzione nelle popolazioni prediabetiche.

Queste nuove aree terapeutiche emergenti per la metformina erano tutte riportate e discusse dagli Autori insieme ai recenti risultati degli studi di farmacogenetica che collegavano le variazioni genetiche di risposta ai farmaci come nuovo passo promettente verso la medicina personalizzata per il trattamento del T2D.
Merethe Hansen dell’University of Copenhagen, Denmark e collaboratori hanno studiato il ruolo della metformina sulla cinetica del glucosio durante l'esercizio fisico moderato (Diabetes Care December 2, 2014).
Gli Autori hanno, così, determinato prima, durante e dopo un incontro di quarantacinque minuti di esercizio fisico al 60% di VO2max la cinetica del glucosio con la tecnica di tracciante isotopico nei pazienti con diabete mellito di tipo 2 in trattamento con metformina (DM2 + Met) o senza (DM2) e nei soggetti sani di controllo (CON) abbinati per BMI ed età. Erano misurati durante lo studio anche gli ormoni glicoregolatori e i metaboliti.
La concentrazione plasmatica di glucosio rimaneva invariata durante l'esercizio fisico nel gruppo CON, mentre diminuiva in quello DM2. Nessun cambiamento significativo si riscontrava nel DM2 + Met. Gli ormoni e i metaboliti non mostravano differenze tra i gruppi, ad eccezione di elevate concentrazioni indotte dall'esercizio fisico nel lattato nel DM2 (area sotto la curva [AUC] 31 ± 1% rispetto al CON) e nel glucagone nel DM2 (AUC 5 ± 1% rispetto al DM2 + Met). I livelli degli acidi grassi liberi erano inferiori nel DM2 + Met rispetto al DM2 (AUC -14 ± 1%). I valori assoluti del Ra (rate of appearance) del glucosio basale erano elevati nel DM2 e nel DM2 + Met, mentre l'aumento del Ra del glucosio rispetto al basale era smussato nel DM2 (19 ± 1%) e nel DM2 + Met (18 ± 4%) rispetto al CON (46 ± 4%). Il tasso di scomparsa del glucosio rispetto al basale aumentava più nel CON (31 ± 3%) rispetto al DM2 (6 ± 1%) e al DM2 + Met (21 ± 2%), che mostrava un piccolo aumento causato dalla metformina. Il tasso di clearance metabolica del glucosio rispetto al basale era simile durante l'esercizio nel DM2 (33 ± 1%) e nel CON (35 ± 3%), mentre migliorava nel DM2 + Met (37 ± 3%) rispetto al DM2.
In conclusione, la metformina mostrava un effetto positivo sull’omeostasi del glucosio durante l'esercizio fisico. In effetti, durante l'esercizio fisico di moderata intensità la velocità di assorbimento del glucosio indotta dalla contrazione muscolare era ridotta nei pazienti con diabete di tipo 2. Pur tuttavia, questa condizione era in qualche misura attenuata da un trattamento concomitante con metformina. Il farmaco, peraltro, non mostrava alcuna interazione significativa con l’esercizio fisico nel diabete di tipo 2 e con nessun miglioramento ulteriore dell’HbA1c.
Mopelola A. Adeyemo del National Institutes of Health e collaboratori, sulla base delle capacità della metformina nel promuovere la perdita di peso, ritenuta almeno in parte attribuibile alla diminuzione dei consumi energetici, hanno studiato i suoi effetti sull’appetito e sull’assunzione di calorie nei bambini obesi iperinsulinemici (Diabetes Obes Metab. 2015 April; 17 (4): 363–370).
Gli Autori rilevavano che vi erano pochi dati riguardanti quest’aspetto del farmaco e, quindi, conducevano una ricerca di sei mesi, randomizzata, controllata con placebo in doppio cieco per valutare gli effetti della metformina 1000 mg due volte il giorno sul peso corporeo e sul bilancio energetico in 100 bambini obesi e iperinsulinemici di età dai sei ai dodici anni.
Rispetto al placebo, il trattamento con metformina suscitava una significativa riduzione, rispetto al basale, nel consumo di energia media aggiustata dopo il carico di prepasto (metformina: -104,7 ± 83,8 kcal vs placebo: + 144.2 ± 96.9 kcal; p = 0,034), indipendente dai cambiamenti nella composizione corporea. La metformina diminuiva significativamente il rating della fame (-1.5 ± 5.6 vs. + 18,6 ± 6,3; p = 0,013) e aumentava il rating di ripienezza (+ 10,1 ± 6,2 vs -12.8 ± 7.0; p = 0.01) dopo il carico del prepasto.
In conclusione, i dati suggerivano che la diminuzione della percezione della fame con conseguente riduzione dell'assunzione del cibo risultava tra i meccanismi attraverso i quali il trattamento con metformina aveva effetto sul calo del peso corporeo nei bambini in sovrappeso con iperinsulinemia.
Effetto pleiotropico della metformina (glucophage)
La pleiotropia definisce in farmacologia quelle azioni, in genere impreviste, di un farmaco, differenti da quelle per le quali è stato intenzionalmente prodotto e distribuito. Questi effetti aggiuntivi, quindi, di solito inattesi e correlati o non al meccanismo primario di azione della sostanza, possono essere negativi, ossia dannosi, o più spesso benefici. Nella cura del cancro, in particolare, sono stati già descritti effetti di farmaci con attività pleiotropica con effetti positivi per la concomitanza di ripristino dell'espressione difettosa dei geni coinvolti nel controllo del ciclo cellulare, dell’apoptosi, della segnalazione cellulare, dell'invasione delle cellule tumorali e delle metastasi, dell'angiogenesi e del riconoscimento immunitario.
Nei riguardi della metformina a tale proposito è utile considerare che la sua proprietà di attivare l’AMPKinasi secondo due separati meccanismi: l'inibizione della fosforilazione ossidativa / trasporto degli elettroni e conseguente decremento del rapporto ATP / AMP e / o l'attivazione diretta dello LKB1. Questo gene LKB1 (chiamato anche STK11) fornisce istruzioni per produrre la serina / treonina chinasi 11, enzima soppressore della tumorogenesi, aiutando le cellule a mantenere una crescita controllata senza divisioni troppo veloci. Oltre al suo ruolo nella regolazione della divisione cellulare, questo enzima aiuta certi tipi di cellule a orientarsi correttamente all'interno dei tessuti (polarizzazione), contribuendo a definire la quantità di energia da utilizzare. Promuove anche il tipo di morte cellulare programmata, nota come apoptosi. Attraverso una combinazione di questi meccanismi, la serina / treonina chinasi 11 aiuta nella prevenzione dei tumori, in particolare del tratto gastrointestinale, del pancreas, della cervice, delle ovaie e del seno. La normale funzione treonina chinasi serina 11 è anche necessaria prima della nascita per il regolare sviluppo.
In aggiunta agli effetti inibitori sulla sintesi proteica, attraverso l'inibizione dello mTOR, l'attivazione dell’AMPK potrebbe avanzare la generazione di memoria dei linfociti T CD8 e sopprimere i segnali della cachessia neoplastica nell'ipotalamo. L’inibizione del trasporto degli elettroni può essere un insulto letale per le cellule tumorali. La metformina, così, mostrerebbe un aumento della memoria delle cellule T CD8 potendo migliorare di conseguenza notevolmente l'efficacia di un vaccino sperimentale anti-cancro.
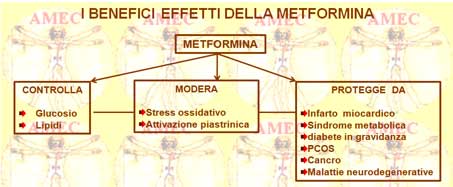
Peraltro, numerosi studi hanno ormai dimostrato il favorevole effetto della metformina sul peso corporeo, sull'insulino-resistenza, sull’iperinsulinemia, sui parametri lipidici (colesterolo totale, colesterolo HDL, colesterolo LDL, trigliceridi), sull'ipertensione arteriosa, sulla fibrinolisi e sulla disfunzione endoteliale. Alla luce di tutto ciò, essa sembra, invero, essere dotata di una vasta gamma di proprietà farmacologiche che la rendono il farmaco potenzialmente applicabile anche in assenza del diabete mellito, come nell’obesità, nell’insulino-resistenza estrema con acanthosis nigricans, nella sindrome dell'ovaio policistico.
Alla luce di tutto ciò, la metformina deve essere considerata un farmaco appropriato di prima linea non solo per il controllo glicemico, ma al di là di questo in altre situazioni. Nel corso degli studi, lo spettro di azione del farmaco si è, quindi, ampliato includendo anche l'endotelio e le ovaie. Peraltro, anche se molte di queste azioni sono singolarmente di modesta portata, appaiono, però, nell’insieme sufficienti a conferire i benefici terapeutici non solo in campo cardiometabolico, ma anche negli aspetti riproduttivi in relazione con l’insulinoresistenza e gli stati proinfiammatori. Peraltro, nei cinquanta anni del suo uso clinico non sono stati riportati grandi rischi e gli eventi avversi gravi attribuibili a essa sono stati di bassa frequenza.
Tra i nuovi agenti ipoglicemizzanti anche i tiazolidinedioni (rosiglitazone e pioglitazone) sono stati studiati ampiamente. Essi hanno dimostrato un effetto favorevole sulla distribuzione del grasso, sul profilo lipidico, sulla fibrinolisi e sulla funzione endoteliale. Inoltre, riducono la pressione sanguigna e i marker infiammatori. Attenuano anche la progressione della CIMT (carotid intima-media thickness) e possono ridurre i tassi di restenosi coronarica seguenti alla PTCA (percutaneous transluminal coronary angioplasty).
Per le glinidi (repaglinide e nateglinide) si sono documentati, per loro conto, miglioramenti nella funzione endoteliale, nel profilo lipidico, nello stress ossidativo, nell'attività delle piastrine, nei marcatori infiammatori e nella progressione della CIMT.
Infine, l’acarbose ha mostrato di poter ridurre significativamente nuovi casi d’ipertensione e degli eventi cardiovascolari, nonché di diminuire la progressione della CIMT nei pazienti con ridotta tolleranza al glucosio. Peraltro è interessante sottolineare che alcuni di questi effetti benefici sembrano essere indipendenti dall'azione antidiabetica.
In definitiva, gli agenti antidiabetici orali stanno emergendo come strumenti utili per l'attenuazione dell’attività aterosclerotica e per la protezione del sistema vascolare nei pazienti con diabete di tipo 2.
A tale proposito, Hong J della Shanghai Jiao Tong University School of Medicine, China e collaboratori hanno voluto confrontare con lo SPREAD-DIMCAD (Study on the Prognosis and Effect of Antidiabetic Drugs on Type 2 Diabetes Mellitus with Coronary Artery Disease), studio clinico controllato con placebo, multicentrico, randomizzato, in doppio cieco, gli effetti a lungo termine della glipizide e della metformina sugli eventi cardiovascolari maggiori nei pazienti diabetici di tipo 2 che avevano una storia di malattia coronarica (Diabetes Care. 2013 May;36 (5):1304-11).
Ciò in considerazione che le due principali classi di farmaci antidiabetici, le sulfoniluree e la metformina, potevano influire in modo differenziale sulle complicanze macrovascolari e sulla mortalità dei pazienti diabetici.
Gli Autori hanno, così, arruolato un totale di 304 pazienti diabetici di tipo 2 con CAD (coronary artery disease) di età media di 63,3 anni (range, 36-80 anni), assegnati per tre anni in modo casuale a ricevere glipizide (30 mg/die) o metformina (1,5 g/die). Gli end point primari erano volti al composito di eventi cardiovascolari ricorrenti, tra cui la morte per qualsiasi causa anche cardiovascolare, infarto miocardico e ictus non fatale, o rivascolarizzazione arteriosa.
Alla fine della somministrazione del farmaco in studio, entrambi i gruppi raggiungevano una significativa diminuzione del livello di emoglobina glicata (7,1% nel gruppo glipizide e 7,0% in quello metformina). Dopo un follow-up medio di cinque anni, novantuno partecipanti sviluppavano 103 endpoint primari. L’analisi ITT (intention-to-treat) mostrava un HR (hazard ratio) di 0.54 (IC 95%= 0,30-0,90; P = 0,026) per i compositi degli eventi cardiovascolari tra i pazienti che avevano ricevuto la metformina, rispetto alla glipizide. Gli end point secondari e gli eventi avversi non risultavano significativamente differenti tra i due gruppi.
In conclusione, la terapia per tre anni con metformina nel follow-up di cinque anni riduceva sostanzialmente del 46% i maggiori eventi cardiovascolari, rispetto a quella con glipizide. Pertanto, gli Autori affermavano che i loro risultati nei pazienti ad alto rischio indicavano un potenziale beneficio della terapia con metformina sugli esiti cardiovascolari.
Berkowitz SA dell’Harvard Medical School, Boston e collaboratori, per determinare l'effetto iniziale di classe degli agenti ipoglicemizzanti orali sulla conseguente necessità di intensificare il trattamento e sui quattro eventi avversi clinici a breve termine, hanno condotto uno studio retrospettivo di coorte su pazienti con prescrizione di un farmaco ipoglicemizzante orale a partire dal luglio 2009 sino al giugno 2013 (JAMA Intern Med. 2014 Dec;174 (12):1955-62).
Gli Autori notavano, difatti, che, anche se molte classi di farmaci ipoglicemizzanti orali erano state approvate per l'uso, esistevano poche evidenze sulla loro efficacia comparativa per guidare la selezione iniziale della terapia del diabete mellito.
Erano, quindi, controllati 15.516 pazienti che avevano incontrato i criteri d’inclusione, di cui 8.964 (il 57,8%) iniziavano la terapia con metformina.
Nell’analisi non regolata l’uso dei farmaci diversi dalla metformina si associava significativamente a un aumento del rischio di aggiungere solo un secondo agente orale, solo l'insulina e un secondo agente o insulina (P <.001 per tutti). In un punteggio di propensione e nei modelli multivariati aggiustati dei rischi proporzionali di Cox l'inizio della terapia con sulfoniluree (hazard ratio [HR], 1,68; IC 95%= 1,57-1,79), con tiazolidinedioni (HR, 1,61; IC 95%= 1,43-1,80) e con DPP-IV (dipeptidyl peptidase-4 inhibitors) (HR, 1,62; IC 95%= 1,47-1,79) si associava a un’intensificazione accresciuta del rischio. I farmaci alternativi alla metformina non erano associati a un rischio ridotto d’ipoglicemia, di accessi al pronto soccorso, o di eventi cardiovascolari.
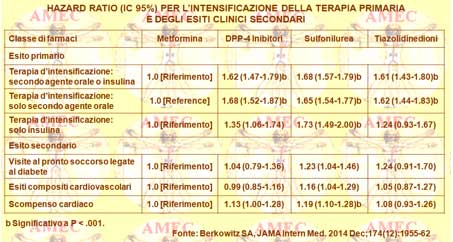
In conclusione, gli Autori affermavano che, nonostante le insistenze delle linee guida, solo il 57,8% dei diabetici iniziava il trattamento con metformina. Di fatto, l’uso della metformina come farmaco iniziale avrebbe fatto ottenere una consequenziale ridotta intensificazione del trattamento, senza differenze nei tassi d’ipoglicemia o di altri eventi clinici avversi. Questi risultati avevano, quindi, implicazioni significative per la qualità della vita dei malati e per i risparmi delle risorse sanitarie.
In effetti, rispetto al 25% dei pazienti con uso di metformina che avevano richiesto un secondo agente orale, il 37% di quelli con sulfonilurea, il 40% di quelli tiazolidinedione e il 36% di quelli con DPP4 erano incorsi in questa necessità. Rispetto a chi usava la metformina, il rischio per il trattamento intensificazione era, quindi, maggiore del 68% tra gli utenti della sulfanilurea, del 61% tra gli utenti tiazolidinedione e del 62% tra gli utenti del DPP4. Inoltre, rispetto alla metformina, l’uso della sulfonilurea si associava a un aumentato rischio di eventi cardiovascolari compositi, d’insufficienza cardiaca congestizia e d’ipoglicemia.
