MODULAZIONE INTESTINALE DEL MICROBIOTA, IL COMPLESSO SISTEMA DI GERMI CHE CONTRIBUISCE ALLA SALUTE DELL’UOMO
Il corpo umano ospita sulla cute e sulla superficie delle mucose numerosi microbi, in proporzione di dieci a uno con le proprie cellule. In particolare, il complesso dei microrganismi dell’intestino, denominato microbiota, costituisce una comunità molto ricca di circa 10-100 trilioni di cellule batteriche che nello svolgere dei millenni si sono probabilmente co-evoluti con i padroni di casa. Esse nell’uomo sano, pur con un’ampia variabilità e diversità inter-individuale, sono caratterizzate dai Bacterioidetes phyla e Firmicutes.
In rapporto a tali premesse, si è giunti a proporre che la stessa definizione di organismo dovrebbe essere aggiornata, includendo questi microrganismi senz’altro utili per la nostra stessa sopravvivenza. L’uomo, difatti, dovrebbe essere definito un meta-organismo di una comunità di entità biologiche che interagiscono tra di loro con caratteristica di un metagenoma di gran lunga più grande di quello che codificano i propri cromosomi.

Come queste migliaia di miliardi di microbi influenzano lo stato di salute umana e quello di malattia è oggetto di numerose ricerche per un chiarimento sempre più convincente in quasi tutte le discipline mediche.
Purtroppo, il riconoscimento del microbiota al fine di prevenire o trattare le malattie è reso difficile a causa della sua complessità, ma anche per la sua variabilità intra e interpersonale. Gli studiosi continuano, in effetti, a prodigare grandi sforzi per individuare i fattori predominanti che determinano la microbiosi intestinale umana e le interrelazioni per la sua composizione, il suo pool di geni (il microbioma), l’espressione delle sue funzioni nella fisiologia e nella malattia. Nel caso particolare dell'intestino, che contiene la più grande collezione di microbi, questi fattori e interrelazioni comprendono la dieta, l’assetto genetico dell’ospite e le relazioni familiari. Pur tuttavia, le variazioni sono determinate anche dalle tradizioni culturali e dalle aree geografiche, dallo stato gravidico, dal tipo di parto, dallo stato di obesità, dalla sindrome metabolica, dal diabete di tipo II, da alcune altre malattie, come la colite da Clostridium difficile, da altre forme di malattie infiammatorie intestinali, dalle patologie cardiovascolari, dalla presenza di disturbi derivati dall’uso degli antibiotici. Sta di fatto che il normale rapporto simbiotico tra organismo umano e microbi è in funzione dell'omeostasi tra le due parti, in ragione soprattutto della diversità dei germi e della loro stabilità. Di conseguenza, le interruzioni di questo equilibrio sono state associate a una serie di processi fisiologici e patologici, come nel caso della malattia infiammatoria intestinale. Sono stati ricondotti a tale processo anche effetti indiretti, come il metabolismo dei farmaci, la generazione di composti antitumorali e lo sviluppo dell’autoimmunità.
Marco Candela dell’University of Bologna, Italy e collaboratori, hanno ribadito la condizione estremamente plastica della flora batterica intestinale in grado di essere riconfigurata in risposta a diversi fattori ambientali, abbandonando l’ormai tradizionale concetto della sua stabilità attraverso l'intero ciclo di vita (Trends Microbiology Vol. 20, Issue 8, p385–391, August 2012).
Gli Autori dichiaravano, in effetti, che in un contesto mutualistico le fluttuazioni del microbioma avrebbero consentito all'ospite di regolare rapidamente il suo metabolismo e le sue prestazioni immunologiche in risposta ai cambiamenti ambientali. Peraltro, varie circostanze avrebbero potuto disturbare questo equilibrio omeostatico, inducendo la microflora intestinale a passare da una configurazione mutualistica a un profilo associato alla malattia. In tal modo, sarebbe stata necessaria una comprensione meccanicistica delle dinamiche coinvolte in questo processo per affrontare più razionalmente il ruolo del microbiota intestinale umano.
Peraltro, David L. A. dell’Harvard University, Cambridge, MA United States e collaboratori hanno dimostrato come il consumo a breve termine di diete interamente composte di prodotti animali o vegetali alteravano la struttura della comunità microbica e travolgevano le differenze inter-individuali nell'espressione genica microbica (Nature Vol. 505, I. 7484, 2014, P. 559-563).
In effetti, la dieta a base animale aumentava la quota di microrganismi tolleranti la bile (Alistipes, Bilophila e Bacteroides), mentre diminuiva i livelli dei Firmicutes che metabolizzavano i polisaccaridi vegetali alimentari (Roseburia, Eubacterium rectale e Ruminococcus bromii). L’attività microbica rispecchiava le differenze tra i mammiferi erbivori e i carnivori, riflettendo compromessi tra i carboidrati e le proteine di fermentazione. I microrganismi di origine alimentare, che comprendevano batteri, funghi e persino virus e derivavano da entrambe le diete, colonizzavano transitoriamente l'intestino. Infine, l’aumento della quota e dell'attività della Bilophila wadsworthia nella dieta a base animale supportava un legame tra i grassi alimentari, gli acidi biliari e la malattia infiammatoria intestinale. In concerto a questi risultati gli Autori dimostravano che il microbioma intestinale poteva rispondere rapidamente alle alterazioni dietetiche, favorita potenzialmente dalla diversità degli stili di vita alimentari umani.
In effetti, il microbiota intestinale è riconosciuto, come già accennato, un complesso di microrganismi evolutosi insieme all’uomo. Questo partner, soprattutto dagli ultimi 10.000 anni della storia del genere umano, facilita, di fatto, l'acquisizione nutrizionale, la funzione immunitaria e la protezione verso le variabili ambientali, aiutando a mantenere l'omeostasi in risposta ai profondi cambiamenti delle abitudini. In effetti, attraverso l'intera sequenza del genoma, si possono osservare direttamente le specializzazioni metaboliche di questo bioma commensale e capire come l’ontogenesi dell’ospite si riflette nel suo potenziale funzionale. Le esplorazioni metagenomiche comparative su diverse popolazioni umane, in effetti, hanno fatto luce su alcuni adattamenti funzionali del microbiota intestinale in diverse tradizioni culturali, nelle pratiche di sussistenza e nelle abitudini dietetiche. Tali adattamenti illustrano, infatti, la sua specificità come fonte di variabilità genetica e di flessibilità metabolica tra gli esseri umani. Specifiche sue configurazioni funzionali, riscontrate in comunità rurali non industrializzate, includono l’arricchimento dell’alfamilasi e della fosfotransferasi. Tutto ciò rispecchia una sussistenza dominata da un’alimentazione contenente polisaccaridi vegetali complessi. Questa impostazione funzionale può riflettere un ecosistema adattivo, come risposta a una migliore disposizione con l’ospite, con supporto nutrizionale sotto forma di metaboliti o di micronutrienti derivati dalla fermentazione dei polisaccaridi vegetali, come gli SCFA (short-chain fatty acids). Al contrario, l'adattamento funzionale nelle diete dei Paesi occidentali industrializzati, arricchite di zuccheri semplici, di proteine animali e grassi comporta l'espressione degli enzimi rivolti alla degradazione degli zuccheri, degli amminoacidi e degli acidi biliari. In tal modo, il microbiota intestinale appare funzionalmente innescato per rispondere ai diversi fattori dietetici. Attraverso il sequenziamento del microbioma umano, oggi si può comprendere meglio come la storia evolutiva e l’ontogenesi dell’ospite si riflette sulla funzione microbica. Pur tuttavia, occorrono informazioni sulla configurazione metagenomica intestinale nelle popolazioni antiche dei cacciatori-raccoglitori.
A proposito di quanto riportato, Alexander V Tyakht della Research Institute of Physico-Chemical Medicine; Moscow, Russia e collaboratori hanno scoperto comunità del microbiota intestinale potenzialmente benefiche nelle popolazioni della Russia rurale in confronto con quelle cittadine (Gut Microbes 5:3, 1–6; May/June 2014).
Questo risultato ha stimolato l’ipotesi che le comunità rurali potessero fungere da fonte di trapianto fecale per combattere particolari malattie del mondo sviluppato.
Dal loro canto Simone Rampelli dell’University of Bologna, Italy e collaboratori hanno presentato la prima analisi metagenomica del microbiota intestinale dei cacciatori-raccoglitori Hadza della Tanzania (Current Biology 25, 1–12, June 29, 2015).
Gli Autori hanno, così, dimostrato un arricchimento unico nelle vie metaboliche che si allineavano con i fattori dietetici e ambientali, caratteristici dello stile di vita di questi popoli. Gli Hadza presentavano un microbiota adattato per un ampio spettro al metabolismo dei carboidrati. Tale condizione rifletteva, di fatto, il complesso polisaccaridico della loro dieta. Inoltre, il microbiota era attrezzato per la degradazione degli amminoacidi ramificati e la biosintesi di quelli aromatici. In effetti, la struttura filogenetica del microbiota intestinale di questo popolo di cacciatori-raccoglitori della Tanzania, caratterizzato con il 16S rRNA, manteneva una strategia di sussistenza essendo basato esclusivamente sui cibi selvatici e sulle fonti d'acqua naturale della regione. In tutto ciò, poi, intervenivano anche le variazioni stagionali e annuali delle precipitazioni con modelli di correlazione con la disponibilità delle risorse alimentari, secondo modelli generali di sfruttamento del territorio. Difatti, durante la stagione delle piogge erano consumati maggiormente alimenti vegetali, mentre durante la stagione secca più carne.
Questi risultati, secondo gli Autori, sottolineavano la necessità di un’estensiva caratterizzazione della funzione del microbioma e del resistoma nelle popolazioni non occidentalizzate prima della globalizzazione.
D’altra parte, la funzionalità del resistoma dimostrava, in questa popolazione con scarsa esposizione agli antibiotici, l'esistenza di geni resistenti a tali farmaci, indicando la continua presenza di resistenze di derivazione ambientale. Gli Autori con i loro risultati dimostravano, quindi, da una parte come la specificità funzionale del microbiota intestinale correlasse con un certo ambiente e stile di vita e dall’altra come la complessità dell’ambiente esogeno potesse essere bilanciata dall’omeostasi endogena. La struttura metagenomica dell'intestino degli Hadza permetteva, quindi, di apprezzare il ruolo funzionale co-adattativo del microbiota intestinale per l’integrazione della fisiologia umana, fornendo una migliore comprensione della versatilità della vita umana e della sussistenza.
Per loro conto, anche Jose C. Clemente dell’Icahn School of Medicine at Mount Sinai, New York, USA e collaboratori hanno voluto caratterizzare il microbioma e il resistoma batterico fecale, orale e cutaneo dei membri isolati di un villaggio di amerindi dell’Alto Orinoco con la più alta diversità di batteri e funzioni genetiche mai segnalata in un gruppo umano. (Sci. Adv. 2015;1:e1500183).
Il villaggio, situato nella giungla amazzonica nel profondo della foresta al confine tra Venezuela e Brasile, non presente su alcuna mappa e individuato solo durante una ricognizione militare, era abitato da alcune tribù di Yanomami senza alcuna nota esposizione ad antibiotici. Questa tribù aveva conservato, da quando i loro antenati erano arrivati nell’America meridionale, le abitudini di vita di più di undicimila anni addietro, come popolo di cacciatori-raccoglitori. Gli Autori rilevavano che la maggior parte degli studi del microbioma umano si era concentrata sulle persone occidentalizzate con pratiche di stili di vita che riducevano la sopravvivenza e la trasmissione microbica, o su società tradizionali al momento in fase di transizione verso l’occidentalizzazione. Si prelevano sul posto campioni della flora batterica cutanea, orale e intestinale in trentaquattro persone, di età compresa fra i quattro e i cinquanta anni. Si eseguiva, poi, il sequenziamento del materiale genetico.
I risultati degli Autori suggerivano che l’occidentalizzazione influenzava significativamente la diversità del microbioma umano e che i geni AR funzionali, cioè quelli resistenti agli antibiotici, sembravano essere una sua caratteristica, anche in assenza di esposizione agli antibiotici commerciali.
Secondo quanto riportato, la comunità microbica dell’apparato gastrointestinale rappresenta, quindi, da qualche tempo un obiettivo interessante di ricerca. In effetti, la composizione della parete intestinale e la presenza dei fattori proinfiammatori sono state a lungo legate alle ulcere, alla malattia infiammatoria intestinale e a quella cronica del fegato. Peraltro, i microbi svolgono nell'intestino anche un ruolo chiave nel metabolismo energetico, per cui, quando la loro comunità si altera, ne può derivare la malattia. Tale dato è stato, ad esempio, esplorato nello sviluppo della NAFLD (nonalcoholic fatty liver disease), in cui l'assunzione del fruttosio ha dimostrato di aumentare la sintesi lipidica, compromettendo la sensibilità all'insulina e aumentando l’adiposità viscerale, che predispone appunto all’epatopatia. L’eccessiva disponibilità di tale zucchero comporta, invero, un’alterazione del microbiota intestinale, un aumento della permeabilità della mucosa, un’infiammazione e, infine, un danno epatico. Al contrario, condizioni adeguate e salutari di una dieta e di un esercizio fisico si sono dimostrate efficaci nell’influenzare il normale metabolismo.
Peraltro, le alterazioni del microbioma con una permeabilità intestinale alterata e con l'infiammazione cronica di basso grado sono state associate anche al diabete e all’obesità. D’altro canto, una dieta ricca di grassi altera anch’essa il microbiota, portando a un aumentato assorbimento di calorie. Inoltre, la riduzione della funzione della barriera intestinale può fornire più facile penetrazione ai microbi, avviando una cascata di risposte immunitarie e uno stato d’infiammazione cronica. È noto, in effetti, che la combinazione di una deregolazione del metabolismo e dell'infiammazione favorisce l'obesità e i disturbi metabolici correlati.
A tale proposito, bisogna sempre ricordare che l'intestino umano ospita il più grande e diversificato ecosistema di microbi del corpo, costituito da più di 400 specie di batteri. Sono presenti cinque phyla: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria e Verrucomicrobia. Due di essi sono dominanti: i Bacteroidetes (Bacteroides, Prevotella e Xylanibacter) e i Firmicutes (Ruminococcus, Clostridium, Lactobacillus, Eubacterium, Faecalibacterium e Roseburia). Pur tuttavia, a causa dell’ambiente e dei fattori dell'ospite, le varie popolazioni presentano variazioni quantitative e qualitative lungo il decorso del tratto gastrointestinale. A tale proposito, infatti, intervengono, il valore del pH, la peristalsi, la disponibilità dei nutrienti, il potenziale di ossidoriduzione all'interno del tessuto, l'età e la salute dell’ospite, l'adesione, la cooperazione e l’antagonismo batterico, le secrezioni di muco contenenti immunoglobuline, il tempo di transito, la presenza di acidi biliari e degli enzimi digestivi.
Nello stomaco degli individui sani la carica batterica è bassa. Gli organismi isolati predominanti sono i lattobacilli, gli streptococchi e i lieviti. Nel duodeno e nell’intestino tenue l'ambiente è acido con il pH tra quattro e cinque. Predominano i lattobacilli e gli streptococchi. Il numero dei batteri nel duodeno è superiore a quello dello stomaco con circa 102-104 CFU (unità formanti colonia) contro i 102. Il microbiota, in rapporto alla diminuzione della velocità di transito dei contenuti e all’aumento del pH intraluminale, cambia, poi, fortemente dal duodeno all’ileo. Aumenta anche la carica batterica sino a 106-108 CFU.
Infine, la popolazione del microbiota del colon raggiunge i 1010-1012 CFU. Un adulto, di fatto, può avere intorno ai 1014 CFU superando, così, in numero le cellule eucariotiche totali di tutto il suo organismo. Nel colon, peraltro, ci sono due fattori associati che contribuiscono alla massima colonizzazione fisiologica: il pH neutro e il più lungo tempo di transito.
Sta di fatto che la funzione principale della flora batterica intestinale è di limitare la crescita dei microrganismi potenzialmente patogeni, prevenendo la loro invasione e la loro realizzazione nell’ecosistema. Inoltre, il microbiota compete per lo spazio e ha la capacità di secernere sostanze antimicrobiche, le batteriocine che inibiscono la proliferazione degli altri batteri. In questo processo, mantiene una stabilità e metabolizza e sottrae prodotti non digeribili. In particolare, la fermentazione dei carboidrati non digeribili produce SCFA, acidi grassi a catena corta, come acetato, propionato e butirrato che svolgono un ruolo importante nella modulazione dei diversi processi nel tratto gastrointestinale. Il butirrato è particolarmente importante come fonte di energia per l'epitelio del colon e l’acetato e il propionato sono utilizzati dal fegato come substrati per la lipogenesi e la gluconeogenesi. Inoltre, gli SCFA possono regolare l'espressione genica, sopprimere l'infiammazione e modulare la secrezione di GLP-1, migliorando quella dell’insulina ed esercitando, così, un effetto antidiabetico.
Ancora, gli SCFA attivano il FFAR (free fatty acid receptor), che è un recettore del GPCR (G-protein-coupled receptor). L’acetato e il propionato sembrano attivare anche il FFAR2 (Free fatty acid receptor 2), il butirrato il FFAR3 (Free Fatty Acid Receptor 3). Questi composti svolgono un ruolo importante come sensori fisiologici per gli acidi grassi liberi derivati dal cibo e dai prodotti di digestione nel tratto gastrointestinale. Peraltro, essi sono coinvolti nella secrezione dell’insulina e delle incretine ormonali e nella regolazione del sistema nervoso simpatico, nelle preferenze del gusto e nelle risposte infiammatorie causate dall’insulino-resistenza. Secondo alcuni Autori, gli SCFA attraverso la modulazione dei recettori specifici sarebbero anche coinvolti nel controllo della pressione arteriosa. Inoltre, bisogna comprendere in questo novero di funzioni il controllo degli elettroliti, come il calcio, il magnesio, il ferro, l’assorbimento dell’acqua, la proliferazione e la differenziazione cellulare, la secrezione di ormoni e l'attivazione del sistema immunitario. Peraltro, per il loro ruolo gli SCFA sono ugualmente utilizzati, anche se in piccola parte, come fonti di energia dal fegato e dai muscoli, ma soprattutto dai colonociti, le cellule di rivestimento del colon.
Sono attribuite, altresì, al microbiota alcune funzioni metaboliche, quali la produzione di vitamine, come la K, la B12, la B5, la biotina, l’acido folico, e la sintesi di aminoacidi dall’ammoniaca o dall’urea.
Il microbiota umano gioca, in definitiva, un ruolo importante nelle attività biochimiche del corpo umano e, oltre a produrre vitamine e altri nutrienti essenziali, regola, come già detto, molti aspetti dell'immunità. Attraverso i propri enzimi costitutivi, la flora microbica intestinale realizza la fermentazione dei nutrienti ingeriti e il metabolismo degli acidi biliari, portando alla loro conversione da primari in secondari. Questi ultimi, poi, agiscono come molecole di segnalazione legandosi ai recettori cellulari implicati nella modulazione dei lipidi e nel metabolismo del glucosio.
Di fatto, la composizione della dieta, il tempo di transito, il pH e i substrati disponibili, che i batteri sono in grado di utilizzare, possono avere un forte impatto sull'ambiente intestinale. Di conseguenza, le variazioni dell'assunzione dei tre principali macronutrienti (proteine, lipidi e carboidrati complessi digeribili e non) influenzano significativamente la composizione della flora intestinale.
I carboidrati non digeribili, in particolare, sono importanti fonti di energia per diversi membri del microbiota del colon.
In definitiva, ormai è noto che il microbiota intestinale ha un ruolo rilevante per la salute assumendo un preciso e importante ruolo nelle malattie gastrointestinali, ma anche extradigestive. Ripristinare la sua presenza fisiologica costituisce, quindi, un obiettivo clinico fondamentale nel trattamento di numerose malattie. Peraltro, la sua modulazione rappresenta, di fatto, un’antica proprietà innata nella razza umana. Ne consegue, quindi, l’importanza del riconoscimento dei fattori che ne influenzano la stabilità e la complessità sia nello stato di salute e sia in quelli di malattia. In effetti, le caratteristiche principali, quali la sua stabilità, la resilienza e la complessità, sono influenzate nel tempo a partire fin dall'infanzia sino all'età adulta e avanzata.
Come prima accennato, nell’intestino sano queste caratteristiche contribuiscono a importanti processi fisiologici, quali la protezione contro gli agenti patogeni, la formazione del sistema immunitario e la digestione del cibo per la fornitura di energia e nutrienti, tra cui le vitamine e lo SCFA. Molti fattori, peraltro, intervengono per influenzare il microbioma durante tutto il suo sviluppo e la sua maturità, tra cui la genetica, la dieta e i farmaci. Da notare, comunque, che alcuni di questi fattori possono introdurre perturbazioni che ne investono la complessità e la stabilità, rappresentando, quindi, potenziali agenti di disbiosi microbica. Un microbioma in squilibrio dimostra, per esempio, un aumento dei batteri gram-negativi legati a uno stress ossidativo, all’infiammazione e alla produzione dei metaboliti nell’ambiente.
In definitiva, è bene ripetere che il commensale microbiota intestinale umano è diventato il focus d’interessi convergenti di diverse discipline, soprattutto in ragione del suo contributo alla definizione dello stato di salute e del rischio di malattia durante tutto l’arco della vita. Peraltro, si sono dimostrati collegamenti tra il cambiamento della sua composizione con quelli del comportamento e dello stile di vita degli individui. Molti degli elementi della vita moderna, in particolare dei primi anni di vita, possono, difatti, influenzare la composizione del microbiota, come alterazioni alle varie età che possono conferire il rischio di malattia. Negli anziani, in particolare, la diversità e la composizione del microbiota sono state collegate con i vari parametri di salute, tra cui i livelli delle citochine infiammatorie. Peraltro, è stato dimostrato che il microbiota può anche rappresentare un rischio o un fattore protettivo riguardo ai disordini immunoallergici e metabolici. In tal modo, come già accennato, si è andata evidenziando una rete di segnalazione tra il microbiota, l’immunità e il metabolismo dell'ospite. Anche i disturbi legati all'obesità sono stati collegati alle alterazioni della flora batterica. L’esercizio fisico e lo stile di vita sedentario hanno pure dimostrato di poterlo modificare, lasciando, quindi, presupporre che gli atleti dovrebbero avere una flora batterica più diversificata rispetto alle loro controparti sedentarie.
Sulla scia di quanto affermato, il ripristino della normale microflora intestinale rappresenta ormai un obiettivo ben codificato nella medicina. A tal proposito, si sono andati sviluppando, soprattutto negli ultimi anni, diversi approcci terapeutici. Antibiotici, prebiotici e probiotici rappresentano, infatti, in commercio le opzioni più note e disponibili per superare la disbiosi intestinale. Inoltre, recentemente la vecchia procedura sul piano clinico terapeutico del trapianto del microbiota fecale sta assurgendo a nuova popolarità, mostrando una chiara efficacia, soprattutto nel trattamento dell'infezione da C. difficile.
Catherine A. Lozupone e il suo gruppo di ricercahanno riportato una meta-analisi sugli studi del microbiota umano (Genome Res. 2013 Oct;23 (10):1704-14.).
Le premesse che suggerivano questa pubblicazione poggiavano sulla considerazione che l’habitat delle comunità microbiche associate al corpo umano era in costante crescente interesse per la ricerca della sua influenza sulla salute.
Peraltro, poiché molti studi erano basati sullo stesso gene 16S RNA ribosomiale (rRNA) batterico, in linea di principio potevano essere confrontati per determinare l'importanza relativa degli stati di malattia / fisiologia / sviluppo diverso. Tuttavia, le differenze nei protocolli sperimentali usati potevano produrre variazioni che superavano le differenze biologiche. Confrontando le sequenze geniche 16S rRNA, generate dai diversi studi sul microbiota umano, utilizzando la banca dati QIIME (Quantitative Insights Into Microbial Ecology), gli Autori scoprivano che la variazione nella composizione del microbiota attraverso i luoghi differenti del corpo era costantemente superiore alla variabilità tecnica tra gli studi.
L’insieme dei risultati mostrava, di fatto, che i confronti tra gli studi sul microbiota umano erano preziosi quando il parametro studiato aveva un grande effetto di misura, mentre, se più sottili, richiedevano popolazioni di controllo attentamente selezionate e protocolli standardizzati.
Noah Voreades della Colorado State University, USA e collaboratori hanno delineato le principali caratteristiche della dieta e dello sviluppo del microbioma intestinale umano (Front. Microbiol. Sep.2014, Front. Microbiol. 5:494)
Gli Autori hanno rimarcato l'importante ruolo del microbioma intestinale nel mantenimento della salute umana per cui ritenevano necessaria una migliore comprensione delle dinamiche temporali delle comunità microbiche intestinali così come dell’ospite e dei fattori ambientali che le guidavano.
Era noto, difatti, che i geni, la modalità di nascita, i modelli di alimentazione infantile, l'uso degli antibiotici, le condizioni sanitarie di vita e le abitudini alimentari, a lungo termine, contribuivano tutti a plasmare la composizione del microbioma intestinale. La dieta, su cui gli studiosi avevano concentrato principalmente la loro recensione, dall'infanzia sino alla tarda età, era uno dei fattori più fondamentali per lo sviluppo del microbioma intestinale umano. In effetti, gli Autori ribadivano che la flora intestinale infantile era caratterizzata da un alto grado d’instabilità e che solo dai due e tre anni si raggiungeva, in coerenza con la costituzione di una dieta varia di cibo solido, uno stato simile a quello degli adulti. I fattori legati all'alimentazione che influenzavano lo sviluppo del microbioma intestinale infantile includevano varianti legate all’alimentazione al seno o artificiale, ma anche alla modalità e al tempo d’inizio dei cibi solidi. In contrasto con l'intestino infantile, il microbioma intestinale adulto era resistente ai grandi cambiamenti di struttura della comunità. Diversi studi avevano, peraltro, dimostrato che i cambiamenti nella dieta inducevano variazioni transitorie nel microbioma degli adulti, a volte in meno di ventiquattro ore. Tuttavia, la comunità microbica ritornava prontamente al suo stato di stabilità. Peraltro, le correnti conoscenze su come le abitudini alimentari a lungo termine formavano il microbioma intestinale erano limitate per la mancanza di studi di alimentazione a lungo termine, accoppiata con la temporale caratterizzazione della flora intestinale. Tuttavia, studi sulla perdita di peso a lungo termine avevano dimostrato un’alterazione del rapporto dei Bacteroidetes e dei Firmicutes, i due principali phyla batterici residenti nel tratto gastrointestinale umano. Con l'invecchiamento, i fattori legati all'alimentazione, come la malnutrizione, si accompagnavano a mutazioni del microbioma, anche se non era stato stabilito il rapporto di causa ed effetto tra essi. Peraltro, negli anziani l’uso di farmaci più diffuso poteva, certo, contribuire a ridurre la stabilità intestinale del microbiota e la sua diversità.
Era anche interessante segnalare che gli alimenti contenenti oligosaccaridi prebiotici, che alimentavano i commensali benefici della comunità intestinale, e gli integratori probiotici erano in fase di studio per intervenire nella modulazione del microbioma intestinale con l’obiettivo di migliorare potenzialmente lo stato di salute.
Dal loro canto Caroline Thum dell’Ag Research Grasslands, Palmerston North, New Zealand e collaboratori nella loro recensione descrivevano l’influenza materna sulla colonizzazione microbica intestinale nel periodo precedente e dopo il parto. In particolare, esaminavano la manipolazione materna sulla composizione del microbiota attraverso l'uso dei probiotici e / o dei prebiotici, valutando anche le possibili successive conseguenze per la salute della prole (J. Nutr. 142: 1921–1928, 2012).
Gli Autori segnalavano, in particolare, che nei primi anni di vita la composizione del microbiota influenzava profondamente lo sviluppo e la maturazione mucosale del tratto gastrointestinale, tanto da poter incidere sulla salute dell’età avanzata e da stimolare strategie per una manipolazione preventiva nei riguardi del complesso microbico. Gli studi in proposito suggerivano che i feti a termine erano sterili e che la colonizzazione batterica iniziale dell’intestino del neonato si verificava solo dopo il transito attraverso il canale del parto. Pur tuttavia, studi più recenti avevano dimostrato che la colonizzazione e / o il contatto del feto con il microbiota intestinale materno potevano iniziare già nella vita intrauterina. Dopo la nascita per via naturale la colonizzazione dell’intestino neonatale continuava attraverso il contatto con i batteri del canale digestivo e vaginale materno. Ciò comportava un’adozione di una relativamente semplice comunità microbica influenzata dal tipo di alimentazione in rapporto alla modalità di allattamento, al seno oppure artificiale. In ogni caso, il microbiota intestinale materno, quello vaginale e la composizione del latte della puerpera erano sempre influenzati dal tipo di dieta di quest’ultima. I benefici della composizione del microbiota intestinale materno sulla prole con l’uso della supplementazione con probiotici e prebiotici non erano, comunque, stati ancora dimostrati.
Anche Madan JC del Children's Hospital at Dartmouth, Lebanon, New Hampshire e collaboratori hanno voluto esaminare in uno studio osservazionale prospettico la composizione del microbioma intestinale di 102 bambini a circa sei settimane di vita, in rapporto alle modalità del parto e del metodo di alimentazione (JAMA Pediatr. 2016 Jan 11:1-8).
I bambini avevano età media gestazionale di 39.7 settimane con un range da 37.1 a 41.9. Settanta erano nati per via vaginale e trentadue con parto cesareo. Nelle prime sei settimane di vita, settanta erano stati allattati esclusivamente al seno, ventisei avevano avuto alimentazione di combinazione e sei erano stati nutriti esclusivamente artificialmente. Gli Autori identificavano associazioni indipendenti tra la composizione della comunità microbica sia con la modalità del parto (P <.001; Q <.001) e sia con quella dell’alimentazione (P = 0,01; Q <.001). Le differenze della composizione della comunità microbica tra i neonati partoriti per via vaginale e quelli da parto cesareo erano equivalenti o significativamente più grandi rispetto a quelle tra i gruppi di alimentazione (P = 0,003). La comunità batterica dell'alimentazione di combinazione era maggiormente simile a quella dell’alimentazione esclusiva artificiale, piuttosto che all’allattamento esclusivo al seno (p = 0,002). S’identificavano anche sei generi di batteri individuali che erano largamente differenziati tra i gruppi con diversa modalità di parto e di alimentazione.
In conclusione, secondo i dati dello studio, il microbioma intestinale infantile, a circa sei settimane di età, era significativamente associato con entrambe le modalità di parto e metodo di alimentazione. Inoltre, l’integrazione di combinazione dell’allattamento materno comportava una composizione del microbioma maggiormente simile a quella dei bambini alimentati esclusivamente artificialmente. Questi risultati, secondo gli Autori, potevano informare le scelte di alimentazione e far luce sui meccanismi che stavano alla base delle conseguenze sulla salute per tutta la vita.
In via collaterale, Nuria Salazar del Consejo Superior de Investigaciones Científicas, Villaviciosa, Spain e collaboratori hanno riassunto le loro conoscenze sulle alterazioni del microbiota intestinale nelle fasi estreme della vita (Front. Genet. 21 nov. 2014, vol 5-art 406).
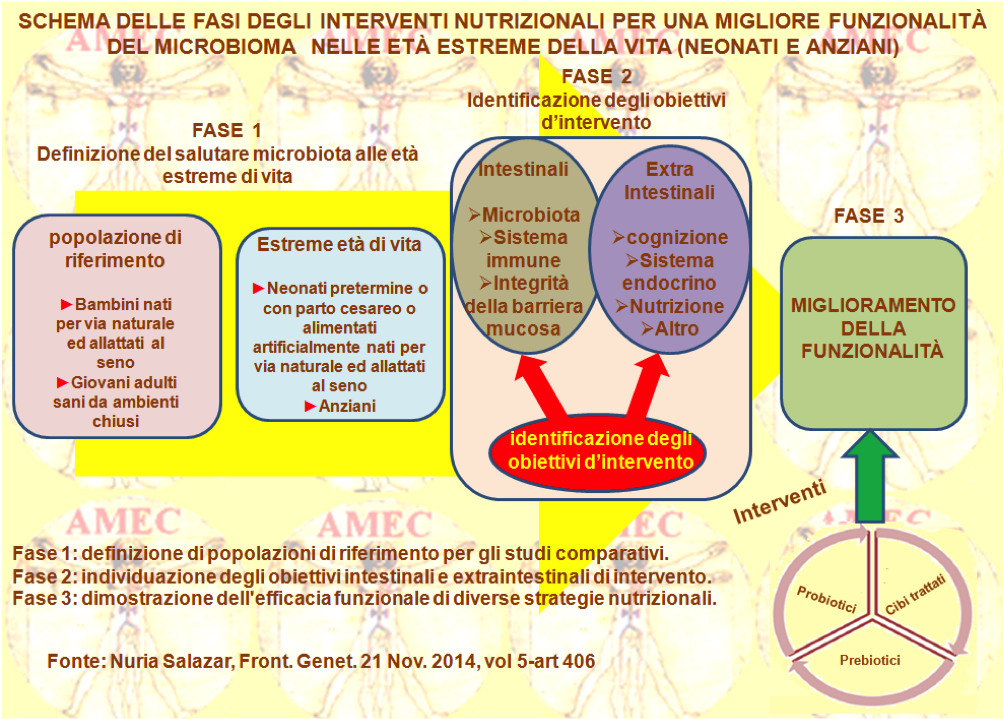
Gli Autori hanno esposto anche gli strumenti per la progettazione di strategie nutrizionali differenziate mediante l'uso dei probiotici, dei prebiotici e dei nutrienti specifici, al fine di ripristinare un microbiota equilibrato e per migliorare lo stato immunitario e nutrizionale.
Degno di nota è lo studio di Siobhan F Clarke dell’University College Cork, Ireland e collaboratori in cui, considerando che molti elementi di un moderno stile di vita influenzano il microbiota intestinale, si è esplorato l’impatto dell’esercizio fisico e della dieta su di esso (Gut 2014. doi: 10.1136/gutjnl-2013-306541).

In definitiva i risultati dimostravano un impatto positivo dell’esercizio sulla diversità del microbiota intestinale, ma indicavano anche che il rapporto era complesso e correlato alle diete estreme.
Per altro verso, la composizione e la diversità del microbiota intestinale sono state dimostrate collegate ai modelli del metabolismo degli estrogeni che, com’è noto, sono predittivi del rischio di cancro al seno nelle donne in postmenopausa. Orbene, L'estrogeno è metabolizzato nel fegato e in altri tessuti come il seno, producendo frammenti che vengono escreti con le urine, o nell'intestino con la bile. Il microbiota può degradare questi metaboliti, permettendo il riassorbimento nel flusso sanguigno e in seguito il riciclaggio nel fegato. Ne deriva che le donne con la maggiore efficienza batterica di elaborazione degli estrogeni possono avere un rischio ridotto di cancro al seno.
Barbara J. Fuhrman dell’University of Arkansas for Medical Sciences e collaboratori hanno condotto uno studio trasversale su sessanta donne sane in postmenopausa, come campione casuale del Kaiser Permanente Colorado, di età dai cinquantacinque ai sessantanove anni in assenza di uso corrente o recente di antibiotici o di terapia ormonale e senza storia di cancro o di malattie gastrointestinali (J Clin Endocrinol Metab. 2014 Dec;99 (12):4632-40).
L’obiettivo era di valutare se gli estrogeni urinari e loro metaboliti fossero associati con la diversità e la composizione del microbioma fecale.
Gli estrogeni, l’estrone e l’estradiolo, e tredici loro metaboliti idrossilati erano misurati nelle urine. Il microbioma fecale era valutato utilizzando il pirosequenziamento dell’amplicone 16S rRNA. Modelli generali lineari erano usati per testare le associazioni di diversità e la composizione del microbioma fecale con l’estrone + l’estradiolo, gli estrogeni totali e i loro metaboliti e il rapporto di questi ultimi con gli ormoni di derivazione. Tale dato era stato indicato in studi precedenti come rischio predittivo del carcinoma della mammella in post-menopausa.
I risultati indicavano il rapporto dei metaboliti sugli estrogeni direttamente associato con la diversità di tutto l’albero filogenetico (R = 0.35, P = .01). La relativa abbondanza dell'ordine Clostridiale (R = 0,32, p = 0,02) e quella dei Genus Bacteroides (R = -0.30, p = 0,03) erano anche correlate con il rapporto dei metaboliti sugli estrogeni. Queste associazioni, peraltro, erano indipendenti dall’età, dall’indice di massa corporea e dai fattori del progetto dello studio.
In conclusione, i dati suggerivano che le donne con un microbioma intestinale più diversificato presentavano un elevato rapporto urinario dei metaboliti degli estrogeni idrossilati con le sostanze di derivazione. Pur tuttavia, ai fini di particolari interpretazioni cliniche gli Autori ritenevano necessarie successive ricerche per una conferma dei loro dati.
