Acidi grassi polinsaturi omega-3: quale utilità?
Enrico Bologna
Specialista in Medicina Interna, Gastroenterologia e Patologia generale.
Già Primario Ospedale Fatebenefratelli, Isola Tiberina, Roma.
Libero docente in Patologia Medica, Università di Roma “Sapienza”.
Riassunto
Gli acidi grassi polinsaturi a catena lunga rappresentano una componente alimentare necessaria per il normale metabolismo cellulare. Quelli della classe ω-3, utilizzati da oltre 35 anni per il trattamento di alcune dislipidemie e par la prevenzione del reinfarto, sono stati recentemente oggetto di discussioni relativamente alla reale utilità in quest’ultima indicazione ma anche alla possibile efficacia in indicazioni completamente diverse.
Summary
Polyunsatured long-chain fatty acids are a component of diet essential for cellular metabolism. Omega-3 PUFA in the last 35 years were widely prescribed for treating hypertriglyceridemia and for secondary prevention of myocardial infarction. Recently, questions were posed on the thrue efficacy in the latter indication, but also on possible utility in other indications.
Nel 1976 uno studio condotto su Eschimesi Inuit dimostrò che nei soggetti residenti in Groenlandia la frequenza delle malattie cardiovascolari era inferiore rispetto a quella osservata in soggetti della stessa etnia residenti in paesi industrializzati (5). Il fenomeno fu attribuito alle differenti abitudini alimentari, in particolare al maggior quantitativo di pesce consumato e quindi degli acidi carbossilici, noti come acidi grassi polinsaturi (PolyUnsatured Fatty Acids, PUFA) assunti dai soggetti residenti in Groenlandia. Da questa osservazione originò un rinnovato interesse per gli acidi grassi essenziali, che erano stati identificati negli anni trenta ma che erano stati oggetto di studio solo come fattori necessari all’accrescimento umano e animale.
L’esistenza di un rapporto tra l’alimentazione e il rischio di reinfarto trovò conferma alla fine degli anni ’80 dai risultati dello studio Diet and Reinfarction, che prese in esame il consumo di pesce, grassi e fibre (9). L’interesse per i PUFA crebbe con i risultati dello studio condotto 10 anni dopo dal Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico (GISSI) (27). Questo studio, condotto su 11.324 pazienti con recente infarto del miocardio, dimostrò una riduzione del 15% del rischio combinato di letalità, infarto non fatale e ictus nei soggetti trattati per tre anni con 1 g/die di PUFA ω-3 a catena lunga (EPA e DHA). In particolare, il rischio di letalità cardiovascolare risultò ridotto del 30% e quello di morte improvvisa del 45%. Un secondo studio (28), effettuato somministrando per un periodo medio di 3,9 anni 1 g/die di PUFA ω-3 a 6.975 pazienti con insufficienza cardiaca cronica, dimostrò che il trattamento si associava con una moderata riduzione dei ricoveri per malattie cardiovascolari e della letalità per tutte le cause. Nel Japan Eicosapentaenoic acid Lipid Intervention Study (JELIS) , condotto per 4,6 anni su 18.645 soggetti ipercolesterolemici di entrambi i sessi trattati con statine, la somministrazione di 1,8 g/die di acido eicosapentaenoico (EPA) si associò ad una riduzione del 19% di eventi coronarici maggiori non fatali, ma non degli eventi fatali (66). Questa apparente limitata efficacia di EPA potrebbe però essere attribuita al fatto che la popolazione in esame faceva ampio uso di alimenti ittici ed aveva quindi elevati valori basali di PUFA . Molti altri studi, condotti in popolazioni e con modalità differenti, hanno successivamente confermato il beneficio dell’alimentazione ittica e dei supplementi a base di PUFA (ω-3 a catena lunga 47).
Ma, più recentemente, alcune ricerche hanno portato a risultati molto differenti. Secondo una metanalisi condotta su 10 studi clinici relativi a 69.480 pazienti ha mostrato che i soggetti trattati con PUFA ω-3 non hanno presentato significativa riduzione della letalità per tutte le cause, della morte cardiaca, della morte improvvisa, dell’infarto miocardico e dell’ictus cerebrale (53). Anche lo studio randomizzato in doppio cieco ORIGIN, condotto su 12.536 soggetti ad alto rischio cardiovascolare e intolleranza glicidica o diabete mellito, ha dimostrato che la somministrazione per 6,2 anni di 1 g/die di PUFA ω-3 non si è associata ad alcuna significativa riduzione di rischio (50).
Ugualmente deludenti i risultati di uno studio, effettuato in Italia, su 12.512 pazienti con malattia aterosclerotica o con molteplici fattori di rischio cardiovascolare seguiti da 860 medici di Medicina generale. I pazienti sono stati trattati con 1 capsula/die contenente 1 g di PUFA ω-3 o 1 g di olio di oliva quale placebo per 5 anni. La letalità e morbosità cardiovascolari non hanno mostrato significative differenze nei due gruppi di pazienti (52). Questo studio è stato criticato per l’uso come placebo di olio di oliva in quanto contenente PUFA, ma la critica appare inconsistente considerando l’elevato uso di olio di oliva nel nostro paese (stimato in oltre 30 g/die).
I contrastanti risultati di questi studi hanno determinato incertezze e dubbi, che in Italia hanno portato dapprima alla modificazione della prescrivibilità dei PUFA ω-3 che, con determinazione AIFA del 26/4/2013 venne limitata al trattamento di secondo livello dei soggetti con iperlipidemia familiare combinata e dei pazienti con insufficienza renale media-grave e ipertrigliceridemia > 500 mg/dl; con la stessa determinazione fu infatti annullata la prescrivibilità a scopo di prevenzione secondaria nei soggetti con pregresso infarto del miocardio. Ma in data 22/11/2013 la prescrivibilità è stata ripristinata per i pazienti con sindrome coronarica acuta con innalzamento di ST o con aumento dei biomarcatori verificatasi nei 90 giorni precedenti.
Per comprendere i motivi di queste incertezze è utile ricordare brevemente il significato biologico dei PUFA. Questi vengono distinti, in base alla assenza o presenza nella molecola di doppi legami, in saturi e rispettivamente insaturi (mono- o polinsaturi secondo il numero dei doppi legami localizzati in corrispondenza degli atomi di carbonio). Il numero dei doppi legami è un fattore determinante, poiché da esso dipendono le caratteristiche funzionali dei PUFA, quali la fluidità delle membrane cellulari in cui essi sono contenuti, l ’attività dei sistemi cellulari di trasporto e degli enzimi legati alla membrana come anche la suscettibilità alla perossidazione dei lipidi. I PUFA a catena lunga, in particolare, sono i precursori di molecole-segnale che a seconda della struttura (ω-3 ovvero ω-6) intervengono in molteplici processi fisiologici, in particolare quelli infiammatori e immunitari, e condizionando la formazione delle VLDL e dei trigliceridi.
I PUFA sono acidi grassi essenziali, cioè non prodotti dai mammiferi che mancano degli enzimi necessari a inserire il doppio legame, il cui apporto è indispensabile per il normale svolgimento delle funzioni biologiche fondamentali sopra ricordate. Al contrario dei mammiferi, alcuni vegetali, e in particolare le alghe unicellulari presenti nel fitoplancton, sono in grado di sintetizzare vari PUFA che quindi passano nei pesci che si cibano di queste alghe. Per inciso, è questo il motivo per cui apporto di PUFA non si ha dai pesci allevati ma solo da quelli pescati in mare.
Le famiglie di PUFA più importanti per il metabolismo umano sono quelle denominate omega-6 (ω-6 o n-6) e omega-3 (ω-3 o n-3). Questa denominazione è basata sulla disposizione del primo doppio legame a partire dal terminale Carbonio (Carbonio ω o Carbonio n). Nelle due famiglie il primo doppio legame si trova quindi nel sesto (ω-6) e rispettivamente nel terzo (ω-3) rango. Tutti i doppi legami sono in configurazione cis, vale a dire i due atomi di idrogeno che vi sono contenuti si trovano dalla stessa parte del piano formato dal doppio legame. Nell’uomo la presenza di particolari enzimi (reduttasi ed elongasi) permette la produzione di vari PUFA a catena lunga a partire dall’acido linoleico per la serie ω-6 e dall’acido linolenico per la serie ω-3.
La denominazione completa di un PUFA, prendendo ad esempio l’ac. α-linolenico (Fig.1), è rappresentata come segue:
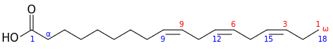
Fig. 1 Ac. α-linolenico (ALA) [acido octadecatrienoico]: (18:3; ω-3; all-cis 9,12,15
La prima cifra indica il numero di atomi di carbonio da cui la molecola è costituita e la seconda il numero di doppi legami; seguono la posizione del primo doppio legame a partire dal terminale ω e successivamente la configurazione (in questo caso cis) e infine la posizione dei doppi legami a partire dal terminale α. (15). Un elenco dei PUFA ω-3 è riportato nelle tabelle 1 e 2.
|
DENOMINAZIONE |
DESCRIZIONE |
|
Ac. esadecatrienoico (HTA) |
16:3; all-cis-7,10,13 |
|
Ac. octadecatrienoico (ALA) [Ac. α-linolenico] |
18:3; all-cis-9,12,15 |
|
Ac. octadecatetraenoico (SDA) [Ac. stearidonico] |
18:4; all-cis-6,9,12,15 |
|
Ac. eicosatrienoico (ETE) |
20:3; all-cis-11,14,17 |
|
Ac. eicosatetraenoico (ETA) |
20:4; all-cis-8,11,14,17 |
|
Ac. eicosapentaenoico (EPA) [Ac. Timnodonico] |
20:5; all-cis-5,8,11,14,17 |
|
Ac. eneicosapentaenoico (HPA) |
21:5: all-cis-6,9,12,15,18 |
|
Ac. docosapentaenoico (DPA) [Ac. clupanodonico] |
22:5: all-cis-7,10,13,16,19 |
|
Ac. docosaesanoico (DHA) [Ac. cervonico] |
22:6: all-cis-4,7,10,13,16,19 |
|
Ac. tetracosapentaenoico |
24:5: all-cis-9,12,15,18,21 |
|
Ac. tetracosaesanoico [Ac. nisinico] |
24:6; all-cis-6,9,12,15,18,21 |
Tab. 1. Omega-3
|
DENOMINAZIONE |
DESCRIZIONE |
|
Ac. octadecaenoico (Ac. linoleico) (LA) |
LA |
|
Ac. octadecatrienoico (Ac. gamma-linolenico) (GLA) |
18:3: all-cis-6,9,12 |
|
Ac. eicosadienoico (EDA) |
20:2; all-cis-11,14 |
|
Ac. Ac. diomo-gamma-linolenico (DGLA) |
20:3: all-cis-8,11,14 |
|
Ac.arachidonico (AA) |
20:4: all-cis-5,8,11,14 |
|
Ac. docosadienoico |
22:2; all-cis-13,16 |
|
Ac. adrenico |
22:4; all-cis-7,10,13,16 |
|
Ac. docosapentaenoico |
22:5; all-cis-4,7,10,13,16 |
|
Ac. tetracosatetraenoico |
24:4; all-cis-9,12,15,18 |
|
Ac. tetracosapentaenoico |
24:5; all-cis-6,9,12,15,18 |
Tab. 2. Omega-6
I principali PUFA ω-3, presenti quasi esclusivamente nei pesci, sono EPA e DHA; i principali PUFA ω-6, per contro, sono contenuti negli oli vegetali e nelle carni e sono rappresentati da GLA e AA.
Una volta ingeriti con gli alimenti, i PUFA ω-6 e ω-3 competono per uno stesso sistema di enzimi, rappresentati da desaturasi e da elongasi, che determinano allungamento e desaturazione delle molecole con la formazione di derivati bioattivi (Fig. 2). Questa competizione per uno stesso sistema enzimatico fa sì che il rapporto quantitativo tra i derivati delle due famiglie di PUFA corrisponda a quello dei PUFA assunti con gli alimenti.
La prima tappa della biotrasformazione dei PUFA dipende dall’intervento di una Δ6 desaturasi che, pur avendo maggiore affinità per ALA che per LA, è utilizzata soprattutto per la catena dei composti ω-6 in quanto prevalenti rispetto agli ω-3 nella alimentazione. Per questo motivo nell’uomo la produzione di EPA e DHA è molto modesta; i livelli di questi PUFA dipendeono soprattutto dall’apporto alimentare, in particolare dal consumo di pesci (31), il cui contenuto in EPA e DHA, derivante come già detto dal consumo di alghe e di plancton, è particolarmente elevato per maccarelli, salmoni, aringhe, alici e sardine (1).
I PUFA ω-3 e ω-6 svolgono numerose funzioni vitali nell’organismo umano. Quali componenti dei fosfolipidi strutturali di membrana modulano il signaling cellulare, le interazioni tra cellule e, come già ricordato, la fluidità delle membrane stesse. Influenzano inoltre il sistema immunitario agendo come precursori di metaboliti eicosanoidi sintetizzati a partire dai PUFA ω-6 (Ac. arachidonico) e ω-3 (EPA) che per l’intervento di Cicloossigenasi (COX) e Lipoossigenasi (LOX) e vengono trasformati nelle prostaglandine immunomodulatrici Trombossano(TX) e leucotrieni (LX).
Questi processi di biotrasformazione coinvolgono preferenzialmente i PUFA ω-3, al cui apporto - per la già ricordata competizione enzimatica - fa riscontro una minor generazione degli eicosanoidi derivati da Ac. arachidonico ed un aumento degli eicosanoidi derivati da EPA e di DHA, caratterizzati da capacità antiinfiammatoria, che si oppone a quella proinfiammatoria dei derivati di Ac. arachidonico (7, 60). La capacità antiflogistica dei PUFA ω-3, che determinano riduzione degli eicosanoidi infiammatori, di citochine (Interleukina 1 e, interleukina 6, TNF-alfa),di molecole di adesione e delle specie reattive dell’ossigeno, dipende da meccanismi diretti, (inibizione del metabolismo dell’acido arachidonico) e indiretti (alterata espressione di geni infiammatori per inibizione dei fattori di trascrizione e produzione di mediatori antiinfiammatori come le resolvine) (10).
I meccanismi mediante i quali i PUFA ω-3 possono influenzare le funzioni dell’apparato cardiovascolare esercitando una protezione antiaterosclerotica sono stati oggetto di una esauriente e recente rassegna si Dessi et al (16). In sintesi, l’incorporazione di EPA e DHA nelle membrane cellulari ne condiziona l’organizzazione, la permeabilità e la fluidità; modifica inoltre l’attività di proteine e strutture transmembrana tra cui recettori, enzimi e canali ionici- In particolare l’azione sui canali di potassio, sodio e calcio modula l’eccitabilità e la contrattilità dei miociti. Questi effetti appaiono svolti soprattutto da DHA. Questo PUFA influenza inoltre il sistema adrenergico e la liberazione di ATP dall’endotelio con aumento della produzione di NO; queste azioni, insieme alla riduzione dei livelli di noradrenalina, spiegano gli effetti antiaritmico, antiipertensivo e bradicardizzante di DHA. Anche la variabilità della frequenza cardiaca, che costituisce un fattore predittivo di morte improvvisa e di aritmie, appare correlato positivamente con i livelli plasmatici di PUFA ω-3. Il benefico effetto di questi derivati nei confronti delle malattie cardiovascolari, e in particolare della malattia coronarica, viene attribuito anche alla capacità di proteggere la funzione endoteliale (18), di ridurre la produzione di trombina e di rendere meno stabile il coagulo fibrinico (23). I PUFA ω-3, inoltre, potenziano l’effetto dei farmaci antiaggreganti (22, 39).
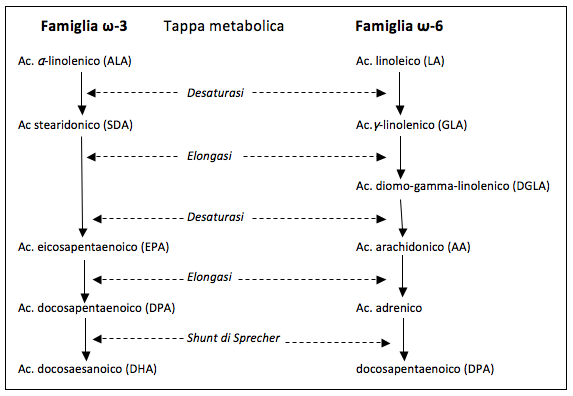
Fig. 2 (Modif. da 35)
I risultati del già citato studio sugli Eschimesi hanno dato luogo a numerose ricerche sul ruolo fisiologico dei PUFA e sulle conseguenze di variazioni dell’apporto alimentare o aggiuntivo di queste sostanze, con particolare attenzione al rapporto fra derivati ω-3 e ω-6. Queste indagini hanno dimostrato che i PUFA ma possiedono numerose proprietà pleiotropiche e sono state oggetto di ampie rassegne fui si rimanda (12, 16). In questa sede verranno sinteticamente riassunte le conoscenze relative al ruolo dei PUFA non solo nelle malattie cardiovascolari, ma anche metaboliche, respiratorie, articolari, neoplastiche e psichiche (13, 33,35, 36, 37). La responsabilità dei PUFA in tutte queste condizioni sarebbe rappresentata da un deficit relativo di ω-3 con eccesso di ω-6, con conseguente accumulo nelle cellule di mediatori appartenenti alle due famiglie di acidi grassi nelle stesse proporzioni in cui sono assunte con l’alimentazione (37:). A questo proposito è da rilevare che dal XX secolo i profondi cambiamenti nella produzione e nella promozione degli alimenti ha indotto un aumento del consumo di derivati ω-6 più che di ω-3 rispetto al passato; questo fenomeno, rilevato dapprima negli USA, si è esteso a tutti i paesi occidentali e, più recentemente, anche a quelli emergenti e in via di sviluppo.
DISLIPIDEMIE
La prima applicazione clinica dei PUFA ω-3 fu quella ipolipemizzante. L’effetto riguarda prevalentemente i trigliceridi la cui riduzione, che può giungere in misura dose-dipendente fino al 30%, deriva da ridotta sintesi epatica e da aumentato catabolismo delle VLDL. I PUFA ω-3 determinano inoltre riduzione della lipemia post-prandiale, lieve aumento delle HDL ed anche delle LDL; quest’ultimo effetto sarebbe perς favorevole in quanto riferibile ad un aumento del volume anzichι del numero di queste particelle, la cui lesivitΰ θ inversamente proporzionale alle dimensioni (59, 42). Per queste caratteristiche, che si associano a buona tollerabilitΰ e assenza di rilevanti interazioni farmacologiche, I PUFA ω-3 trovano indicazione nelle ipertrigliceridemia primarie e secondarie (55 ). Ne è stata inoltre dimostrata l’efficacia in soggetti con steatoepatite non alcoolica, condizione spesso associata a malattie cardiovascolari, sindrome metabolica e diabete mellito (43)-
ARITMIE
Alcuni grandi studi clinici controllati (DART, GISSI, GISSI HF) (9 , 40, 62) hanno dimostrato che il trattamento con PUFA ω-3 riduce il rischio di aritmie ed aumenta la sopravvivenza di soggetti infartuati e di pazienti con insufficienza cardiaca su base ischemica. Questi favorevoli risultati non hanno trovato conferma nello studio Alpha Omega (34 ), condotto su soggetti anziani infartuati fino a 4 anni prima dell’inizio del trattamento con PUFA ω-3 . Questa discordanza di risultati potrebbe essere spiegata con la minore entità della dose di ω-3 somministrata in questo studio, dal più tardivo inizio del trattamento e dall’uso di altri PUFA nel gruppo di controllo. I PUFA ω-3 svolgerebbero forse una azione protettiva contro le aritmie in soggetti portatori di defibrillatori impiantabili, mentre non sembrano ridurre la ricorrenza di fibrillazione dopo cardioversione elettrica (8,19).
IPERTENSIONE ARTERIOSA
Secondo una metanalisi condotta su 36 studi clinici randomizzati la somministrazione di PUFA ω-3 si associa ad una lieve riduzione della pressione arteriosa (- 2,1 mm Hg per la sistolica, -1,6 mm Hg per la diastolica). Gli autori, considerando che la riduzione dei valori pressori osservata in questa metanalisi è minore rispetto a quella rilevata in singoli studi, attribuiscono la differenza al fatto che in alcune delle indagini da essi prese in esame i PUFA sono stati somministrati in forma non purificata e/o a bassa dose, mentre in altri la pressione arteriosa non era compresa tra gli end-point maggiori (11, 25).
INSUFF CARDIACA CRONICA
Miglioramenti della frazione di eiezione ventricolare sinistra associati al trattamento con PUFA ω-3, 1 g/die, sino stati osservati nello Studio GISSI HF (28) come anche, a dosi di 4 g/die, dopo trattamento con 4 g/die per 3 mesi (45).
Anche in soggetti con cardiomiopatia dilatativa la somministrazione di PUFA ω-3 per un anno si è associata ad aumento significativo della frazione di eiezione ventricolare sinistra (49). A questi rilievi fa riscontro quello di una significativa riduzione della concentrazione plasmatica di peptide natriuretico atriale in uno studio condotto su soggetti trattati con 2 g/die di PUFA ω-3 (70). Questi favorevoli risultati sono stati messi in relazione con i già ricordati effetti dei PUFA sulla funzione endoteliale e con l’’effetto antiaritmico.
INSUFFICIENZA RENALE
In soggetti con nefropatia diabetica e da IgA la somministrazione di PUFA ω-3 si è accompagnata a diminuzione della proteinuria ed a miglioramento del quadro lipidico, mentre in pazienti dializzati il trattamento si è associata a maggior durata degli accessi vascolari. Nei soggetti nefropatici,inoltre, i PUFA esercitano un sensibile effetto antiipertensivo (46) ed una elevata efficacia ipotrigliceridemizzante (21, 65,67)
MALATTIE NEUROLOGICHE E PSICHICHE
I PUFA ω-3 sono presenti in elevata concentrazione nel sistema nervoso centrale dei mammiferi, dove favoriscono le attività sinaptiche, proteggono l’integrità dei neuroni in condizioni di ischemia e svolgono attività antiapoptosica (44). Per questi motivi l’effetto dei PUFA è stato valutato nei confronti del danno ischemico, del declino cognitivo senile e della demenza di Alzheimer. I discordanti risultati di queste osservazioni, dipendenti anche da disomogeneità qualitativa e quantitativa dei trattamenti, non permettono di trarre conclusioni (2, 26,30, 51,61,63)
Risultati in gran parte positivi sono stati invece osservati nelle sindromi depressive, in particolare in quelle di maggior gtravità, in quelle perimenopausali,in quelle senili e in quelle che accompagnano la malattia di Parkinson. Questa azione antidepressiva sembra dipendere soprattutto da EPA, mentre DHA avrebbe effetto molto minore (3, 14, 20, 41, 54)
NEOPLASIE
Le alterazioni della fisiologia cellulare responsabili della comparsa e dello sviluppo delle neoplasie sono rappresentate da autosufficienza dei segnali di crescita, insensibilità ai segnali inibenti la crescita, attività antiapoptosica, illimitata capacità re plicativa, angiogenesi protratta,invasività e metastatizzazione, riprogrammazione del metabolismo energetico ed inibizione della distruzione immunitaria (32). La possibile capacità dei PUFA ω-3, in particolare di EPA e DHA, di proteggere dalle neoplasie dipenderebbe da inibizione del metabolismo di AA, interferenza con le citochine coinvolte nella genesi delle neoplasie, inibizione dell’angiogenesi e della diffusione. In particolare i PUFA svolgerebbero, insieme ad un effetto antiinfiammatorio, una azione antitumorale mediante processi immunomodulatori capaci di modificare la produzione di LT, PG, TX e di indurre la produzione di altre molecole come le resolvine e le protectine (4, 60). Queste potenzialità dei PUFA ω-3, rilevate in studi sperimentali, non hanno trovato adeguata conferma negli studi clinici nei quali, peraltro, la valutazione dell’apporto dietetico è soggetta ad un largo margine di errore; ma l’unico studio condotto con la somministrazione di EPA e DHA ha dimostrato che questa era significativamente associata ad un risotto rischio di neoplasia mammaria, mentre il consumo dii acidi grassi monoinsaturi era significativamente associato con un rischio aumentato (57).Appare verosimile che la discordanza di risultati sia da mettere in rapporto sia con la diversità delle dosi di PUFA, sia con la frequenza di mutazioni dei geni preposti al metabolismo dei PUFA (56).
L’efficacia dei PUFA nei confronti dell’infiammazione ha stimolato numerose ricerche miranti a stabilirne l’efficacia in condizioni morbose caratterizzate da infiammazione. Risultati positivi sono stati riportati in alcune malattie respiratorie, in particolare asma, e in molte malattie reumatologiche in cui, come nel caso dell’artrite reumatoide e del lupus sistemico, i PUFA riducono significativamente la necessità di utilizzare i FANS (12). Efficacia è stata inoltre riferita in pazienti con malattie infiammatorie intestinali (24,29, 68, 64, 58).
EFFETTI AVVERSI
L’osservazione che i PUFA ω-3 possono far aumentare il tempo di sanguinamento e quindi favorire emorragie in soggetti a rischio in quanto trattati con aspirina o anticoagulanti ovvero sottoposti a interventi su cuore o arterie ha dato luogo a vari studi clinici controllati il cui esito ha escluso questo rischio. La capacità dei PUFA ω-3 di favorire la comparsa di diabete mellito tipo 2 è stata oggetto di vari studi, che hanno fornito risultati contrastanti. Mentre lo Studio Womens’ Health Initiative ha mostrato che l’apporto di PUFA ω-3 superiore a 2 g/die si associa ad una incidenza significativamente maggiore di diabete (17), è stato rilevato che il DM2 è meno frequente nelle popolazioni con elevato consumo di prodotti ittici (48). Una recentissima metanalisi, condotta su studi relativi agli effetti del consumo di pesce e di prodotti a base di PUFA ω-3 non ha mostrato alcuna significativa associazione con l’incidenza di diabete, mentre ha rivelato l’esistenza di una notevole eterogeneità di risultati che comunque appaiono prevalentemente favorevoli (53, 69).
In conclusione, a fronte di valide documentazioni di efficacia in varie condizioni morbose, il valore terapeutico o preventivo dei PUFA non è ancora ben definibile la maggior parte delle ricerche cliniche finora condotte presentano aspetti criticabili relativamente a differenze qualitative e/o quantitative nell’alimentazione ittica, diversità genetiche, diversità in composizione e purezza dei preparati di PUFA.
In particolare varie metanalisi, come quella di Rizos +( ), dalle quali non risulta alcun effetto benefico dei PUFA, presentano vari aspetti discutibili: l’inserimento nelle casistiche esaminate di soggetti trattati sia con modificazioni alimentari sia con preparati di PUFA e, in questi ultimi, con dosi variabili da 1 a 6,2 g/d e con contenuto in PUFA variabile e con rapporto EPA/DHA compreso fra 0,5 e 2 (ricordiamo che nei preparati disponibili in Italia il contenuto in PUFA è non inferiore all’85% e che il rapporto EPA/DHA è compreso tra 0,5 e 1,5); in alcune casistiche, peraltro, era somministrato solo EPA.. La durata mediana del trattamento, inoltre, era compresa tra 1 e 6,2 anni con mediana di 2 anni, quindi con alcuni studi durati troppo poco per valutare la capacità preventiva nei confronti di molte affezioni, soprattutto cardiovascolari eneoplastiche. Altri problemi sono rappresentati dalla possibile influenza degli altri trattamenti attuati nei soggetti studiati, in particolare quelli con statine, anticoagulanti r antiaggreganti e con altri farmaci attivi sull’apparato cardiovascolare. Appare evidente la necessità di ulteriori indagini controllate condotte in popolazioni omogenee con una stessa fonte di PUFA avente contenuto adeguato sia di EPA che di DHA nelle proporzioni standard .
.
FONTI ALTERNATIVE DI PUFA OMRGA-3
L’apporto di PUFA ω-3 mediante consumo di pesce trova alcune limitazioni, rappresentate dal progressivo depauperamento del patrimonio ittico provocato dal continuo aumento della pesca e in particolare dall’impiego di metodi che non ne rispettano l’ecosistema; un’altra importante limitazione è costituita dalla contaminazione da metilmercurio, che secondo i dati del Natural Resource Defense Council statunitense è elevatissima nei pesci predatori (fra cui Pesce spada, Cernia, Pesce specchio atlantico, Maccarello reale, Squalo, Sgombro reale) ed elevata in molti altri (fra cui Branzino, Ombrina, Halibut, Trota di mare, Pesce serra, Tonno). In tutti i casi la concentrazione di mercurio nelle carni di questi pesci è proporzionale alle loro dimensioni: infatti gli esemplari di maggiori dimensioni divorano quelli più piccoli e il mercurio così assunto non viene eliminato. Per quanto riguarda il tonno va considerato che il contenuto in mercurio, è minore nelle confezioni in scatola poiché queste sono preparate con gli esemplari più piccoli. Basso contenuto in mercurio caratterizza invece aringhe, alici, naselli, sardine e sogliole. A questo proposito è opportuno ricordare che nelle capsule contenenti olio di pesce, disponibili in molti paesi anche europei la presenza di mercurio è trascurabile in quanto questo metallo nelle carni dei pesci è legato in grandissima parte alle proteine e ben poco alla frazione lipidica.
I problemi legati al consumo di pesce e le incertezze sul valore dei preparati disponibili in commercio hanno indotto a cercare fonti alternative di PUFA. Tali ricerche riguardano gli oli provenienti da vegetali (soprattutto di Boraginaceae e Primulaceae) contenenti ac. stearidonico quale precursore di EPA e soprattutto l’olio di alghe, in particolare della varietà Schizohytrium, molto ricca di DHA (38).
Ma oltre ai vegetali e alle alghe, una risorsa è rappresentata dalle noci, particolarmente ricche in acido α-linoleico (ALA), e cioè del precursore di acido eicosapentaenoico (EPA) e di acido docosapentaenoico (DPA). Gli effetti del consumo di noci sono stati oggetto di uno studio, pubblicato nel novembre 2013, condotto su due ampie coorti di professionisti sanitari (76.464 donne seguite per 30 anni (1980 – 2010) nel Nurses’ Health Study e 42.464 uomini seguiti per 25 anni (1986 – 2010) nel Health Professionals Follow-up Study) per un totale di oltre 3 milioni di persone-anno.
Lo studio, nel corso del quale si sono registrati 16.200 decessi tra le donne e 11.229 tra gli uomini, ha preso in esame il rapporto tra consumo di noci e letalità totale e causa-specifica.
Il consumo di noci è risultato significativamente associato in misura inversa con la letalità in entrambe le coorti; questa associazione è risultata tanto più stretta quanto maggiore era il consumo settimanale di noci. L’associazione inversa è risultata ugualmente significativa per le morti provocate da neoplasia, cardiopatia e malattia respiratoria (6).
BIBLIOGRAFIA
1 ACKMAN, R. G “Fatty acids in fish and shellfish,” in Fatty Acids. In Foods and Their Health Implications, C. K. Chow,Ed.,pp. 155-185, CRC Press, London, UK, 2008
2 AMMANN EM, POTTALA JV, HARRIS WS & al: Omega-3 fatty acids and domain-specific cognitive aging: Secondary analyses of data from WHISCA. Neurology. 2013:81,1484
3 APPLETON KM, ROGERS PI, NESS AR: Updated systematic review and meta-analysis of the effects of n-3 long-chain polyunsatured fatty acids on depressed mood. Am J Clin Nutr 2010:91, 757.
4 AZRAD M, TURGEON C, DEMARK-WAHNEFRIED W: Current evidence linking polyunsatured fatty acids with cancer risk and progression. Frontiers Oncol 2013:3,224
5 BANG HO, DYENBERG J, HJøORNE N: The composition of food consumed in Greenland Eskimos. Acta Med Scand 1976: 200, 69
6 BAO Y, HAN J, HU F B & al:Association of Nut Consumption with Total and Cause-Specific Mortality. N Engl J Med 2013:369,2001
7 BARBOSA V M, MILES, E A, CALHAU, CE & al: Effects of a fish oil containing lipid emulsion on plasma phospholipid fatty acids, inflammatory markers, and clinical outcomes in septic patients: a randomized, controlled clinical trial, Critical Care,14, no R5, 2010
8 BIANCONI L, CALO` L, MENNUNI M, et al. n-3 polyunsaturated fatty acids for the prevention of arrhythmia recurrence after electrical cardioversion of chronic persistent atrial fibrillation: a randomized, double-blind, multicentre study.Europace 2011; 13: 174-81.
9 BURR ML, FEHILY AM, GILBERT IF & al: Effects of changes in fat, fish, and fiber intakes on death and myocardial reinfarction. Lancet 1989:2,757
10 CALDER PC: n-3 polyunsatured fatty acids, inflammation, and inflammatory disease. Am J Clin Nutr 2006:83(Suppl 6),15055
11 CICERO AFG, ERTEK S, BORGHI C: Omega-3 polyunsaturated fatty acids: their potential role in blood pressure prevention and management. Curr Vasc Pharmacol 2009;7,330.
12 CICERO AFG, REGGI A, PARINI A & al: Application of polyunsatured fatty acids in internal medicine: beyond the established cardiovascular effects. Arch Med Sci 2012:8,784
13 COCKBAIN AJ, TOOGOOD GJ, HULL MA,: Omega-3 polyunsatured fatty acids for the treatment and prevention of colorectal cancer. Gut 2012:61,135
14 DA SILVA TM, MUNHOZ RP, ALVAREZ C & al: Depression in Parkinson’s disease: a double-+blind, randomized, placebo-controlled pilot study of omega-3 fatty acids supplementation. J Affect Disord 2008:111,351
15 DE FILIPPI A, SPERLING I: Understanding omega-3: Am Heart J 2006:151,564
16 DESSI M, NOCE A, BERTUCCI O & al: Atherosclerosis, dislipidemia, and inflammation: the significant role of polyunsaturated fatty acids. ISRN Inflamm 2013:May 12, 191823.
17 DJOUSSÉ L, GAZIANO JM, BURING JE & al: Dietary omega-3 fatty acids and fish consumption and risk of type 2 diabetes. Am J Clin Nutr. 2011;93:143
18 EPERT S, STELE P: Impact of n-3 fatty acids on endothelial function: results from human interventions studies. Curr Opin Clin Nutr Metab Care 2011:14,121
19 FINZI AA, LATINI R, BARLERA S & al: Effects of n-3 poly - unsaturated fatty acids on malignant ventricular arrhythmias in patients with chronic heart failure and implantable cardioverter-defibrillators: a substudy of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Insufficienza Cardiaca (GISSI-HF) trial. Am Heart J 2011; 161: 338-43.
20 FREEMAN MP, HIBBEIN JR, SILVER M & al: Omega-3 fatty acids for major depressive disorder associated with the menopausal transition: a preliminary open trial. Menopause 2011:18,279
21 FRIEDMAN AN: Omega-3 fatty acid supplementation in advanced kidney disease. Semin Dial 2010; 23: 396
22 GAJOS G, ROSTOFF P, UNDAS A & al: Effects of polyunsaturated omega-3 fatty acids on responsiveness to dual antiplatelet therapy in patients undergoing percutaneous coronary intervention: the OMEGA-PCI (OMEGA-3 fatty acids after pci to modify responsiveness to dual antiplatelet therapy) study. J Am Coll Cardiol 2010; 55: 1671
23 GAJOS G, ZALEWSKI J, ROSTOFF P & al: Reduced thrombin formation and altered fibrin clot properties induced by polyunsaturated omega-3 fatty acids on top of dual antiplatelet therapy in patients undergoing percutaneous coronary intervention (OMEGA-PCI clot). Arterioscler Thromb Vasc Biol 2011; 31:1696
24 GALARRAGA R, HO M, YOUSSEF HM & al: Cod liver oil (n-3 fatty acids) as an non-steroidal anti-inflammatory drug sparing agent in rheumatoid arthritis. Rheumatology 2008:47,665.
25 GELEIJNSE JM, GILTAY EJ, GROBBEE DE & al: Blood pressure response to fish oil supplementation: metaregression analysis of randomized trials. J Hypertens 2002:20,1493.
26 GELEIJNSE JM, GILTAY EJ, KROMHOUT D. Effects of n-3 fatty acids on cognitive decline: a randomized, double-blind, placebo-controlled trial in stable myocardial infarction patients. Alzheimer’s Dement 2011 Oct 2. [Epub ahead of print]
27 GISSI Investigators: Dietary supplementation with n-3 polyunsatured fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto miocardico. Lancet 1999:354,447
28 GISSI-HF Investigators: Dietary supplementation with n-3 polyunsatured fatty acids in patients with chronic heart failure (the GISSI-HF Trial): a randomized, double blind, placebo-controlled trial. Lancet 2008:372,1223
29 GOLDBERG RJ, KATZ J: A meta-analysis of the analgesic effect of omega-3 polyunsatered fatty acid supplementation for inflammatory joint pain. Pain 2007:129,210
30 GORBY HE, BROWNAWELL AM, FALK MC. Do specific dietary constituents and supplements affect mental energy? Review of the evidence. Nutr Rev 2010;68,697
31 GOYENS P L,. SPILKER M E,. ZOCK P L & al: Conversion of -linolenic acid in humans is influenced by the absolute amounts of -linolenic acid and linoleic acid in the diet and not by their ratio, Am J Clin Nutrition, 2006:84,44,.32 HANAHAN D, WEINBERG RA: Hallmarks of cancer: the next generation, Cell 2011,144, 646,.
32 HANAHAN D, WEINBERG RA: Hallmarks of cancer: the next generation, Cell 2011,144, 646,.33 HIBBELN JR, MIEMINEN IK, BLASBALG TL & al: Healthy intakes of n-3 and n-6 fatty acids: estimation considering worldwide diversity. Clin Nutr 2006:65,1483S
34 KROMHOUT D, GILTAY EJ, GELEIJNSE JM; Alpha Omega Trial Group. n-3 Fatty acids and cardiovascular events after myocardial infarction. N Engl J Med 2010; 363: 2015-26.
35 LANDS B: A critique of paradox in current advice on dietary lipids. Prog Lipid Res 2008:47,77
36 LANDS WEM: Diets could prevent many diseases. Lipids 2003:48,317
37 LANDS WEM: Fish, Omega-3 and human health, 2nd ed, AOCS Press, Champaign, IL, USA 2005
38 LENIHAN-GEELS G, BISHOP KS, FERGUSON LR: Alternative sources of omega-3 fays: we can find a sustainable substitute for fish? Nutrients 2013:5,1301
39 LEV EI, SOLODKY A, HAREL N & al. Treatment of aspirin-resistant patients with omega-3 fatty acids versus aspirin dose escalation. J Am Coll Cardiol. 2010;55:114
40 MARCHIOLI R, BARZI F, BOMBA E & al. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto Miocardico (GISSI)-Prevenzione. Circulation 2002; 105: 1897-903.
41 MARTINS JG: EPA but not DHA appears to be responsible for the efficacy of omega-3 long-chain polyunsatured fatty acid suplementation in depression: evidence from a meta-analysis of randomized controlled trials. J Am Coll Nutr 2009:28,525.
42 MASSON CL, MENSINK RP: Exchanging saturated fatty acids for (n-6) polyunsatured fatty acids in a mixed meal may decrease postprandial lipemia and markers of inflammation and endothelial activity in overweight men. J Nutr 2011:141,816
43 MASTERTON GS, PLEVRIS JN, HAYES PC. Review article: omega-3 fatty acids – a promising novel therapy for nonalcoholic fatty liver disease. Aliment Pharmacol Ther 2010;31: 679-92.
44 MAYURASAKORN K, WILLIAMS JJ, TEN VS & al: Docosahexaenoic acid: brain accretion and roles in neuroprotection after brain hypoxia and ischemia. Curr Opin Clin Nutr Metab Care 2011; 14: 158
45 MOERTL D, HAMMER A, STEINER S & al:, Dose-dependent effects of omega-3-poly -unsaturated fatty acids on systolic left ventricular function, endothelial function, and markers of inflammation in chronic heart failure of non ischemic origin: a ouble-blind, placebo-controlled, 3-arm study. Am Heart J 2011; 161:915
46 MORI TA, BURKE V, PUDDEY J & al: The effects of omega-3 fatty acids and enzyme Q0 on blood pressure and heart rate in chronic kidney disease: a randomized controlled trial. J Hypertens 2009:27,1863
47 MOZAFFARIAN D: Fish and n-3 fatty acids for the prevention of fatal coronary heart disease and sudden cardiac death. Am J Clin Nutr 2008:87,1991S
48 NKONDJOCK A, RECEVEUR O: Fish-seafood consumption, obesity, and risk of type 2 diabetes: an ecological study, Diabetes and Metabolism, 200:29,635,
49 NODARI S, TRIGGIANI M, CAMPIA U & al: Effects of n-3 polyunsaturated fatty acids on left ventricular function and functional capacity in patients with dilated cardiomyopathy. J Am Coll Cardiol 2011; 57: 870-
50 ORIGIN Trial Investigators: n-3 fatty acids and cardiovascular outcomes in patients with dysglycemia.
N Engl J Med. 2012 Jul 26;367(4):309
51 QUINN JF, RAMAN R, THOMAS RG & al. Docosahexaenoic acid supplementation and cognitive decline in Alzheimer disease: a randomized trial. JAMA 2010;304,1903
52 RISK AND PREVENTION STUDY COLLABORATIVE GROUP: n-3 fatty acids in patients with multiple cardiovascular risk factors.N Engl J Med. 2013 May 9;368(19):1800
53 RIZOS EC, NTZANI EE, BIKA E & al: Association between omega-3 fatty acid supplementation and risk of major cardiovascular disease events: a systematic review and meta-analysis.JAMA. 2012:308,1024
54 RONDANELLI M, GIACOSA A, OPIZZI A:Long-chain omega-3 polyunsatured fatty acids supplementation in the treatment of elderly depression: effects on depressive symptoms, on phospholipids fatty acids profile and on health-related quality of life. J Nutr Health Aging 2011:15,37.
55 SAMUEL S, PESKIN B, ARONDEKAR B, & al. Estimating health and economic benefits from using prescription omega-3 fatty acids in patients with severe hypertriglyceridemia. Am J Cardiol 2011; 108: 691-7
56 SCHAEFFER L, GOHLKE H, MULLER M & al: Common genetic variants of the FADSI FADS2 gene cluster and their reconstructed haplotypes are associated with the fatty acid composition in phospholipids. Hum Mol Genet 2006:15,1745
57 SCZANIECKA AK, BRASKY TM, LAMPE JW & al: Dietary intake of specific fatty acids and breast cancer risk among postmenopausal women in the VITAL color. Nutr Cancer 2012:64,1131.
58 SHUBERT R, KITZ R, BEERMANN C & al: Effect of n-3 polyunsatured fatty acids in asthma after low-dose allergen challenge. Int Arch Allergy Immunol 2009:148,321.
59 SKULAS-RAY AC, KRIS-ETHERTON PM, HARRIS WS & al: Dose-response effects of omega-3 fatty acids on tfiglycerides, inflammation and endothelial function in healthy persons with moderate hypertriglyceridemia. Am J Clin Nutr 2011:93, 2439.
60 STEPHENSON JA, AL-TAAN O, ARSHAD A& al: The multifaceted effects of omega-3 polyunsaturated Fatty acids on the hallmarks of cancer. J Lipids. 2013;. Epub 2013 May 16.
61 TANAKA K, ISHIKAWA Y, YOKOYAMA M, & al: Reduction in the recurrence of stroke by eicosapentaenoic acid for hypercholesterolemic patients: subanalysis of the JELIS trial. Stroke 2008;39,2052
62 TAVAZZI L, MAGGIONI AP, MARCHIOLI R & al. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomized, double blind, placebo-controlled trial. Lancet 2008; 372: 1223-30.
63 TERANO T, FUJISHIRO S, BAN T & al. Docosahexaenoic acid supplementation improves the moderately severe dementia from thrombotic cerebrovascular diseases. Lipids 1999;34,345
64 TRIANTAFILLIDIS JK, MERIKAS E, GEORGEOPOULOS F: Current and emerging drugs for the treatment of inflammatory bowel disease. Drug Des Devel Ther 2011:5,185
65 UCHIYAMA-TANAKA Y, MORI Y: Effects of eicosapentaenoic acid supplementation on immunoglobulin A nephropathy. Ther Apher Dial 2010; 14: 303-7.
66 YOKOHAMA M, ORIGASA H, MATSUZAKI M & al: Effects of eicosapentaenoic acid on major coronary events in hypercholesterolaemic patients (JELIS): a randomized open-label, blinded endpoint analysis. Lancet 2007:369,1090
67 WONG CY, YIU KH, LI SW & al: Fish-oil supplement has neutral effects on vascular and metabolic function but improves renal function in patients with type 2 diabetes mellitus. Diabet Med 2010; 27: 54
68 WRIGHT SA, O’PREY FM, McHENRY MT & al: A randomized interventional trial of omega-3 polyunsatured fatty acids on endothelial function and disease activity in systemic lupus erythematosus. Ann Rheumatol Dis 2008:67,841
69 ZHANG M, PICARD-DELAND E, MARETTE A: Fish and Marine Omega-3 Polyunsatured Fatty
Acid Consumption and Incidence of Type 2 Diabetes: A Systematic Review and Meta-Analysis.
Int J Endocrinol. 2013. Epub 2013, Sep 8
70 ZHAO YT, SHAO , TENG LL & al: Effects of n-3 polyunsaturated fatty acid therapy on plasma inflammatory markers and N-terminal pro-brain natriuretic peptide in elderly patients with chronic heart failure. J Int Med Res 2009;37: 1831











.png)





