USO DEI FARMACI NEI SOGGETTI OBESI
Enrico Bologna
Specialista in Medicina Interna, Gastroenterologia e Patologia generale.
Già Primario Ospedale Fatebenefratelli, Isola Tiberina, Roma.
Libero docente in Patologia Medica, Università di Roma “Sapienza”.
L’eccesso di peso corporeo, che è di osservazione sempre più frequente nelle aree economicamente sviluppate ed in tutte le fasce di età, costituisce notoriamente un fattore di rischio per molte malattie ed in particolare per quelle cardiovascolari, metaboliche ed osteoarticolari. I soggetti obesi sono inoltre esposti ai rischi connessi con le alterazioni della cinetica - e quindi dell’effetto - che l’obesità provoca a carico di molti farmaci, non esclusi quelli richiesti per il trattamento delle affezioni favorite dall’obesità stessa. A questo proposito merita di essere considerato che nei soggetti obesi il consumo di farmaci è di regola più elevato rispetto ai soggetti normopeso: in Italia, secondo i dati forniti dal Ministero della Salute, la differenza raggiunge il 78%. Sempre in Italia, secondo una recente ricerca condotta nel periodo 2001-2003 su un campione di 4.974 soggetti, il maggior uso di farmaci ed il più frequente ricorso ad ospedalizzazioni comporta un aggravio di spesa sanitaria di 670 milioni di €, pari allo 0,9 della spesa pubblica totale1.
Dai dati pubblicati dall’Osservatorio Cardiovascolare Italiano risulta che nel 2004 un eccesso ponderale era presente nel 66,9% degli uomini (di cui il 17,2% erano classificabili come obesi) e nel 55,2 delle donne (di cui il 21,0% classificabili come obese) 2.
Al diffondersi dell’obesità non ha fatto riscontro un ampliamento delle conoscenze sulla necessità e sulle modalità di adattamento della posologia dei singoli farmaci nei soggetti soprappeso. Di fatto, vi è una sostanziale carenza di informazioni sull’influenza dell’eccesso ponderale sulla cinetica e sull’azione dei farmaci; ciò soprattutto perché la grandissima maggioranza dei farmaci sono stati e sono tuttora studiati in popolazioni costituite da soggetti non obesi. Eppure, sappiamo oggi che il tessuto adiposo non è solo una importante sede di deposito, ma è dotato di molteplici attività biologiche. Nulla tuttavia conosciamo sulla eventuale capacità degli adipociti di intervenire nel metabolismo dei farmaci, né sulle differenze che in questo senso possono esistere fra grasso sottocutaneo e grasso viscerale. Questo aspetto potrebbe risultare ancora più importante se si considera che il rapporto tra massa grassa viscerale e grasso corporeo totale subisce un costante aumento con l’età3.
In farmacologia la personalizzazione della terapia consiste nell’adattamento delle dosi e delle modalità di somministrazione alle variabili biologiche proprie di ciascun individuo; ma è innegabile che mentre molta attenzione viene posta alle condizioni patologiche (come l’insufficienza renale o epatica), a quelle fisiologiche (come età o gravidanza) e, negli ultimi anni, anche a quelle genetiche (soprattutto etniche), le variazioni della struttura somatica solo raramente sono prese in considerazione quando si pianifica un trattamento farmacologico. Tuttavia gli obesi presentano aumento assoluto sia della massa magra, sia della massa grassa: la prima è però responsabile solo del 20 – 40% dell’eccesso di peso, e perciò la percentuale di massa magra per Kg di peso corporeo è diminuita, mentre quella di massa grassa è aumentata e può giungere quasi a raddoppiarsi.
La principale alterazione farmacocinetica prevedibile come conseguenza dell’obesità è certamente l’aumento del volume di distribuzione, parametro da cui dipendono fra l’altro l’emivita di eliminazione ed il tempo necessario per raggiungere la concentrazione plasmatica stazionaria dei farmaci, come anche il tempo occorrente perché, alla sospensione del trattamento, un farmaco possa considerarsi completamente eliminato dall’organismo.
Le possibili conseguenze farmacocinetiche dell’aumento del tessuto adiposo sono ben comprensibili se si considerano le caratteristiche di questo tessuto, soprattutto in confronto con il tessuto muscolare striato, che costituisce una quota rilevante del peso corporeo. Il contenuto idrico dell’adipe è 13%, quello del muscolo 79%; il rapporto acqua intracellulare/acqua extracellulare 3,50 e rispettivamente 0,42; il flusso ematico (in % della portata cardiaca) 5% e 22%.
L’aumento della massa adiposa, quindi, si configura nella presenza di una maggiore quota di tessuto povero di acqua soprattutto intracellulare, poco vascolarizzato ed a lento ricambio; nell’adipe, inoltre, è particolarmente rapido l’ingresso delle molecole liposolubili rispetto a quelle idrosolubili. Nei soggetti con obesità patologica il flusso sanguigno per grammo di tessuto adiposo è ridotto rispetto ai già bassi valori propri dell’adipe. Nei grandi obesi, inoltre, l’efficienza cardiaca si riduce in misura proporzionale al grado di obesità. Tutto ciò indica che le caratteristiche emodinamiche dell’obeso sono tali da poter provocare alterazioni farmacocinetiche. Infatti la minore perfusione ematica può essere responsabile, nel caso di farmaci liposolubili, di ritardato raggiungimento dell’equilibrio tra concentrazione plasmatica e concentrazione tessutale con conseguenti alterazioni sia delle concentrazioni plasmatiche stesse, sia dell’emivita plasmatica di eliminazione. E’ quindi evidente che l’obesità può condizionare il destino di molti farmaci in modo differente secondo le caratteristiche fisico-chimiche delle diverse molecole.
In particolare, l’aumento del peso corporeo non si accompagna ad un corrispondente aumento dell’acqua corporea totale. Perciò, rispetto ai soggetti normopeso, negli obesi il volume di distribuzione assoluto (cioè misurato in litri) di vari farmaci è maggiore, mentre il volume di distribuzione corretto per il peso (cioè misurato in litri per Kg di peso corporeo) è minore per i farmaci prevalentemente idrofili, mentre è nettamente maggiore per i farmaci lipofili. Per questi ultimi farmaci tale aumento comporta, a parità di clearance, un prolungamento dell’emivita plasmatica di eliminazione.
I farmaci idrofili, meno spesso soggetti a biotrasformazione, vengo in molti casi escreti immodificati dal rene. Quelli lipofili, per contro, sono di solito soggetti a importanti processi metabolici e si distribuiscono estesamente anche al tessuto adiposo, dove si possono depositare previa dissoluzione nel grasso neutro. Pertanto, sono soprattutto questi ultimi i farmaci la cui cinetica è più sensibilmente alterata in presenza di un eccesso ponderale e che, soprattutto se caratterizzati da ampio volume di distribuzione e da lunga emivita di eliminazione, possono dare luogo nell’obeso ad effetti imprevisti.
L’obesità, tuttavia, può rendere problematico anche l’impiego dei farmaci idrofili. Infatti, se le dosi di un farmaco idrofilo vengono aumentate in misura proporzionale all’eccesso ponderale si può esporre il paziente a rischi di iperdosaggio, dal momento che – come sopra ricordato - il contenuto idrico del tessuto adiposo è nettamente inferiore a quello della massa magra e che quindi il farmaco verrebbe a trovarsi distribuito in un volume inferiore a quello previsto sulla sola base del peso corporeo. Questo rischio, tuttavia, potrebbe essere reso meno grave dal fatto che gli obesi presentano di regola un filtrato glomerulare superiore a quello medio normale, caratteristica questa che viene attribuita ad un maggior numero e/o ad una maggiore efficienza dei singoli nefroni: ed infatti i farmaci idrofili vengono eliminati in gran parte per filtrato glomerulare.
Si deve sottolineare, comunque, che sarebbe erroneo tentare di prevedere le modificazioni indotte dall’obesità a carico di un farmaco solo in base alla maggiore o minore idro- o lipofilia del farmaco stesso, come del resto in base ad ogni altra caratteristica fisico-chimica isolatamente considerata. Solo tenendo conto di tutte le proprietà di un farmaco è possibile (anche se comunque difficile) adeguare le modalità di somministrazione ai soggetti obesi.
Per prevedere la cinetica di un farmaco in un soggetto obeso al fine di stabilirne il dosaggio adeguato occorre fare riferimento ad un indice che descriva le caratteristiche della struttura e della composizione di quel soggetto. Questo descrittore dovrebbe permettere di valutare il soggetto in questione rapportandone la struttura e la composizione corporea alla media di quelle dei soggetti nei quali è stata studiata la cinetica del farmaco in questione.
I metodi correntemente utilizzati per adeguare le dosi dei farmaci al peso corporeo sono basati su misure delle dimensioni corporee (peso attuale, indice di massa corporea, superficie corporea, etc.); l’impiego di questi metodi presuppone necessariamente che le caratteristiche corporee strutturali e funzionali degli obesi siano analoghe a quelle dei soggetti normopeso. Se questa assunzione può essere accettata per i soggetti “normopeso” di taglia diversa, non può esserlo certamente per gli obesi, nei quali l’eccesso di peso si accompagna a variazioni spesso rilevanti del rapporto tra massa magra e adipe 4.
Un descrittore ideale della composizione somatica dovrebbe incorporare tutte le caratteristiche che possono influenzare la cinetica dei farmaci, vale a dire razza, sesso, età, peso, altezza e composizione corporea. Ma quanto si avvicinano a questo ideale i descrittori attualmente utilizzati o disponibili?
Esaminiamoli sinteticamente.
Indice di massa corporea (Body Mass Index, BMI)
E’ il descrittore più comunemente impiegato per definire la presenza e l’entità dell’eccesso ponderale; è costituito dal rapporto tra peso (Kg) e altezza (m)2. Ma questo indice descrive la composizione corporea dell’obeso in modo utile ai fini del dosaggio dei farmaci? E comunque, a questi fini, BMI è il migliore tra i descrittori fino ad oggi proposti? 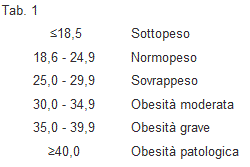 Questo descrittore è stato sviluppato, sulla base dell’”Indice di Quetelet” proposto nel 1869, per valutare il rapporto tra peso corporeo e rischio di malattia coronarica: nel1998 è raccomandato dall’OMS per ottenere una classificazione delle dimensioni corporee valida per tutti gli individui eccetto gli adolescenti, le donne in gravidanza, le persone anziane nelle quali l’altezza non è misurabile con precisione, gli atleti e tutti gli individui con muscolatura molto sviluppata. (Tab. 1). Dal punto di vista farmacocinetico, peraltro, BMI presenta il grave inconveniente di considerare unitariamente massa muscolare e massa magra e sotto questo profilo può essere ingannevole; Va inoltre ricordato che BMI è originariamente derivato da osservazioni compiute su 7.426 soggetti esclusivamente di sesso maschile5.
Questo descrittore è stato sviluppato, sulla base dell’”Indice di Quetelet” proposto nel 1869, per valutare il rapporto tra peso corporeo e rischio di malattia coronarica: nel1998 è raccomandato dall’OMS per ottenere una classificazione delle dimensioni corporee valida per tutti gli individui eccetto gli adolescenti, le donne in gravidanza, le persone anziane nelle quali l’altezza non è misurabile con precisione, gli atleti e tutti gli individui con muscolatura molto sviluppata. (Tab. 1). Dal punto di vista farmacocinetico, peraltro, BMI presenta il grave inconveniente di considerare unitariamente massa muscolare e massa magra e sotto questo profilo può essere ingannevole; Va inoltre ricordato che BMI è originariamente derivato da osservazioni compiute su 7.426 soggetti esclusivamente di sesso maschile5.
Superficie corporea (Body Surface Area, BSA)
BSA = peso (Kg) 0,425 x altezza (cm) 0,725 x 0,007184
una versione più semplice ma meno accurata è la seguente:
√(altezza (cm) x peso (Kg) / 3.600
Questo descrittore, sviluppato nel 1916 e successivamente perfezionato in base a misurazioni anatomiche ottenute nei due sessi, è comunemente ritenuto il miglior indice ai fini delle chemioterapie antineoplastiche, in quanto ritenuto biologicamente accettabile, anche se presenta il difetto di non considerare il sesso6.
Ma consideriamo il seguente esempio: un soggetto obeso grave (altezza 160 cm, peso 90 Kg, BMI 35,1) ed un soggetto normopeso (altezza 190 cm, peso Kg 80, BMI 24,7) hanno la stessa superficie corporea (circa 2 m2) e sono destinati a ricevere la stessa dose di chemioterapico. Considerando le ovvie notevoli differenze nella composizione corporea di questi due ipotetici soggetti, possiamo ritenere valido questo descrittore per adeguare la dose di farmaco alla struttura dei soggetti in questione?
Peso corporeo ideale (Ideal Body Weight, IBW)
Questo descrittore, espresso in Kg, rappresenta il peso corretto per il sesso, l’altezza e la struttura somatica. Esso deriva dai dati raccolti dalla Metropolitan Life Insurance Company di New York nel 1942-43 e aggiornati nel 1959-60 con quelli ottenuti da un sottogruppo di 360.000 soggetti inclusi nel Build and Pressare Study. In base a questi dati la taglia corporea è stata messa in relazione con la mortalità nella popolazione maschile e femminile. Oltre alle tabelle in base alle quali si può confrontare il peso del soggetto in esame con quello ideale, è stata proposta una stima empirica 7 8:
45,4 + 0,89x(altezza (cm) – 152,4) [+ 4,5 per soggetti di sesso maschile]
Dati gli scopi per i quali è stato sviluppato, questo indice non tiene conto di nessun parametro rilevante dal punto di vista farmacocinetico e pertanto l’impiego di esso per stabilire la dose dei farmaci è quanto meno discutibile.
Massa magra (Fat-Free Mass, FFM)
FFM = 0,285 x TBW + 12,1 x altezza (m)2 [uomo]
FFM = 0,287 x TBW + 9,74 x altezza (m)2 [donna]
Questo descrittore è stato ottenuto misurando, in soggetti dei due sessi, peso, altezza, spessore della plica cutanea, densità corporea e potassio corporeo totale. Altri metodi per la valutazione della massa magra utilizzano dati impedenzometrici invece che densitometriche. Poiché tiene conto di peso, altezza e sesso, FFM appare utilizzabile a fini farmacocinetici9.
Peso della massa magra (Lean Body Weight, LBW)
LBW = 1,1 x peso (Kg) – 0,0128 x BMI x peso (Kg) [uomo]
LBW = 1,07 x peso (Kg) – 0,0148 x BNI x peso (Kg) [donna]
Questo descrittore è stato ideato con finalità non farmacocinetiche, ma con lo scopo di correlare la struttura corporea con i dati epidemiologici di morbilità e mortalità. Anche se è stato sviluppato a partire da misure condotte su soggetti di peso sensibilmente inferiore rispetto a quello dei soggetti attualmente considerati obesi, è ritenuto un discreto predittore della cinetica dei farmaci idrosolubili: come già ricordato, questi infatti diffondono prevalentemente nei muscoli e negli organi paranchimatosi, compresi gli emuntori10 11.
Peso corporeo corretto (Adjusted Body Weight, ABW)
ABW = IBW + fc x (TBW – IBW)
E’ questo il primo descrittore sviluppato espressamente per l’impiego in analisi farmacocinetiche. Nella sua prima applicazione (1938) fu utilizzato per adeguare le dosi degli antibiotici aminoglicosidi. Il fattore di correzione (fc) varia secondo l’antibiotico considerato (0,45 per Gentamicina, 0,42 per amikacina, 0,37 per Tobramicina)10.
Percentuale di peso ideale (Percent Ideal Body Weight, %IBW)
%IBW = TBW/IDW x 100
Descrive quantitativamente il peso attuale in percentuale del peso ideale quale è desumibile dalle apposite tabelle; ha un valore modesto ai fini farmacocinetici 9 10.
Peso normale previsto (Predicted Normal Weight, PNW)
PNWT = 1,57 x TBW – 0,0183 x BMI x TBW – 10,5 [uomo]
PNWT = 1,75 x TBW – 0,0242 x BMI x TBW – 12,6 [donna]
Questo indice, introdotto nel 2003 per descrivere la cinetica dei farmaci 6, rappresenta il peso normale previsto per un obeso in base alla somma della massa magra e della massa grassa normale, escludendo cioè l’eccesso di massa adiposa. Comporta gli errori derivati dall’introduzione di LBW, ma è utile perché considera sesso, TBW e altezza.
Per comprendere quale dei numerosi descrittori soprariportati possa considerarsi più indicato per finalità di farmacocinetica clinica, cioè per modificare la dose dei farmaci in base alla costituzione corporea del paziente, si deve valutare la correlazione dei singoli descrittori con i principali parametri farmacocinetici, in particolare clearance e volume di distribuzione.
Un accurato confronto a questi fini è stato recentemente compiuto da Green e Duffull 11, 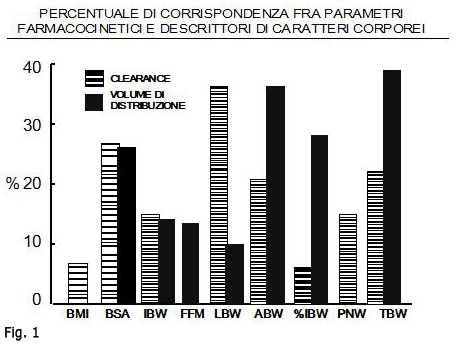 i quali hanno preso in considerazione tutti gli studi sull’argomento disponibili fino al Fig. 12003. Il risultato di questo confronto è riportato nella Fig. 1. Come si può rilevare, nessun indice mostra una corrispondenza superiore al 40% con i parametri farmacocinetici considerati; comunque, la massima corrispondenza con la clearance è data dal Peso della massa magra (LBW), mentre il Peso corporeo totale (TBW) appare come il miglior indicatore del volume di distribuzione. Appare inoltre manifesto che l’Indice di massa corporea (BMI), per il quale i dati disponibili hanno consentito di valutare solo il rapporto con la clearance, ha con questa una corrispondenza di poco superiore al 5%.
i quali hanno preso in considerazione tutti gli studi sull’argomento disponibili fino al Fig. 12003. Il risultato di questo confronto è riportato nella Fig. 1. Come si può rilevare, nessun indice mostra una corrispondenza superiore al 40% con i parametri farmacocinetici considerati; comunque, la massima corrispondenza con la clearance è data dal Peso della massa magra (LBW), mentre il Peso corporeo totale (TBW) appare come il miglior indicatore del volume di distribuzione. Appare inoltre manifesto che l’Indice di massa corporea (BMI), per il quale i dati disponibili hanno consentito di valutare solo il rapporto con la clearance, ha con questa una corrispondenza di poco superiore al 5%.
Da quanto fin qui riportato si possono trarre alcune conclusioni, prima fra tutte che nessun descrittore della struttura corporea è in grado di fornire una indicazione se non approssimativa sulle variazioni farmacocinetiche indotte dalla struttura corporea stessa, e comunque che l’Indice di massa corporea, contrariamente a quanto spesso ritenuto, è completamente privo di valore a questi fini.
Negli obesi sono state compiute osservazioni volte a stabilire l’esistenza di altre eventuali modificazioni, associate all’obesità ma indipendenti dalle variazioni della costituzione corporea a questa collegate, capaci di influenzare la cinetica dei farmaci. Per quanto riguarda la funzione epatica (in questi soggetti è frequente il rilievo di statosi dell’organo) e in particolare quella degli isoenzimi del Citocromo P450 (CYP) gli studi, peraltro non sistematici, hanno dato luogo a risultati discordanti (ad esempio, aumento della attività del CYP2E1 e riduzione di quella di alcune isoforme di CYP3A) e quindi non tali da portare a conclusioni generalizzabili. Il legame dei farmaci con le proteine plasmatiche è stato oggetto di alcune ricerche, che sembrano dimostrare normalità del legame con l’albumina; l’aumento del peso corporeo, invece, si accompagna spesso ad una maggiore concentrazione plasmatica di alfa-1glicoproteina acida, la cui modesta entità non appare tale da poter determinare significative alterazioni farmacocinetiche. Per quanto riguarda infine la capacità escretoria del rene le ricerche, anche in questo caso non sistematiche, indicano che l’eliminazione di alcuni farmaci (per esempio Ciproflossacina, Gentamicina, Litio) non differisce rispetto ai soggetti normopeso, mentre la clearance renale di Vancomicina è nettamente aumentata nei soggetti con obesità patologica.
Vista la complessità del problema, ai fini pratici le decisioni sarebbero certamente più semplici e più sicure se fosse possibile fare uso di schemi posologici specifici per i soggetti obesi. Schemi di questo tipo, anche se non numerosi, sono disponibili ma derivano da risultati ottenuti, per lo più dopo singole dosi dei vari farmaci, in un numero limitato di soggetti con obesità di grado rilevante ma verosimilmente eterogenei per varie caratteristiche (etnia, età, funzione epatica, etc.). In questi schemi, inoltre, la modificazione della dose si basa esclusivamente sulla presenza di “soprappeso”, senza indicazioni utili a differenziare i soggetti il cui eccesso ponderale è riferibile soprattutto o esclusivamente ad adipe.
Quali principi conviene allora seguire nella farmacoterapia in soggetti obesi?
- Per i farmaci la cui eliminazione ha luogo mediante processi di biotrasformazione, poiché la clearance metabolica è funzione della massa cellulare dei parenchimi dotati di questa funzione (principalmente il fegato) e del flusso ematico che li per fonde, il descrittore più adeguato è LBW. A parte ciò, negli obesi la clearance delle molecole soggette a reazioni di Fase 1 è in genere invariata, anche se è segnalata iperattività dell’isoenzima CYP2E1 con più rapida trasformazione di alcuni farmaci (per es. Alotano, Isoniazide, Ondansetron, Paracetamolo, Ritonavir, Teofillina). Anche per alcuni farmaci soggetti a reazioni di fase 2 la clearance è accelerata (per es. Lorazepam, Ossazepam, Paracetamolo). (O’Shea; Morgan).
- Per i farmaci eliminati dal rene come tali (o come metabolici attivi) la dose va regolata in base al filtrato glomerulare, ma resta da accertare quale sia il metodo più affidabile per calcolarlo nell’obeso. Se si utilizza la nota formula di Cockroft & Gault, il peso attuale va sostituito con il peso della massa magra, chè è verosimilmente un miglior indicatore della massa nefronica e del flusso ematico renale che non il peso totale.
- Negli obesi la biodisponibilità dei farmaci somministrati per via sottocutanea è spesso ridotta, mentre ciò non avviene per la via intramuscolare (purché l’iniezione venga correttamente eseguita con ago di lunghezza adeguata ad attraversare lo strato adiposo). Il legame dei farmaci all’albumina plasmatica non è alterato, mentre quello alla α1-glicoproteina acida aumenta, secondo alcune osservazioni, in rapporto con una maggior concentrazione di tale proteina, comportando un aumento della concentrazione plasmatica totale (ma non di quella libera e quindi attiva!) di molti farmaci basici.
- La dose dei farmaci somministrati in acuto, soprattutto se lipofili, deve essere modificata secondo il peso corporeo totale (TBW); ciò al fine di raggiungere rapidamente la concentrazione plasmatica efficace nonostante l’aumentato volume di distribuzione. I regimi terapeutici protratti devono essere invece attuati, nella maggior parte dei casi, con dosi rapportate alla massa magra (LBW), cioè al descrittore che meglio si correla con la massa e quindi con la funzione dei parenchimi emuntori.
In ogni caso la somministrazione negli obesi di farmaci con stretto margine terapeutico impone una attenta sorveglianza e, ove possibile, il monitoraggio delle concentrazioni plasmatiche dei farmaci stessi. In tema di cinetica dei farmaci nell’obesità sarebbe interessante disporre di informazioni sulla biodisponibilità di farmaci somministrati per os negli obesi sottoposti a by-pass digiuno-ileale, ma le pubblicazioni su questo tema sono poche e sempre relative ad osservazioni condotte su singoli casi e perciò non generalizzabili, considerando le diverse tecniche utilizzate dalla chirurgia riduttiva sull’intestino tenue e quindi le forti variabilità degli effetti indotti da tali interventi, che comunque sono spesso molto rilevanti. Può valere come esempio quello di Tacrolimus, la cui biodisponibilità in un soggetto con trapianto di fegato si è ridotta del 90% 26.
Nelle Tabelle seguenti sono riportati i descrittori che, in base ai dati desunti dalle pubblicazioni elencate in bibliografia dal n.12 in poi, appaiono più attendibili per alcuni gruppi di farmaci.





RIASSUNTO
Nell’obesità la cinetica e gli effetti di molti farmaci sono modificati, ma non esiste una modalità unica di adeguare il dosaggio dei singoli farmaci agli obesi. Il ricorso alla misura pià ampiamente nota, rappresentata dall’Indice di massa corporea, può essere ingannevole; lo stesso si può dire di altri indici pure largamente utilizzati, come la superficie corporea.
Dopo una rassegna critica dei numerosi descrittori della struttura corporea, vengono riportati i dati – peraltro limitati – sulle modalità di adattamento delle dosi ai soggetti sovrappeso per alcuni gruppi di farmaci di maggior interesse pratico.
BIBLIOGRAFIA
-
LUCIONI C & al: The costs of metabolic syndrome in Italy
High Blood Press Pre 2006:13,53 -
Osservatorio Epidemiologico Cardiovascolare Italiano
Ital Heart J 2004:5,495 -
UTZSCHNEIDER KM al: Impact of abdominal fat and age on insulin sensitivity and beta-cell function,
Diabetes 2004:53,2867 -
KJELLBERG J, REIZENSTEIN P: Body composition in obesity.
Acta Med Scand 1970:188,161 -
KEYS A al:Indices of relative weight and obesity.
J Chron Dis 1972:25,329 -
MOESTELLER RD: Simplified calculation of body surfaced area.
N Engl J Med 1987:317,1098 - SOCIETY OF ACTUARIES: Build and Blood Pressure Study. New York, Peter Mallon, 1959
-
DEVINE D: Case study number 25 gentamicin therapy.
Drug Intell Clin Pharm 1974:8,650 -
GARROW J, WBSTERJ: Quetelet’s index (W/H2) as a measure of fatness.
Int J Obesity 1985:9,147 -
BAUER LA al:Influence of weight on aminoglycoside pharmacokinetics in normal weight and morbidly obese patients.
Eur J VìClin Pharmacol 1983:24,643 -
GREEN B, DUFFULL SB: What is the best size descriptor to use for pharmacokinetic studies in the obese?
Br J Clin Pharmacol 2004:58,119 -
CHEN M 6 al: Comparative pharmacokinetics ond pharmacodynamic target attainmente of Ertapenem in normal weight, obese, and extremely obese adults.
Antimicrob Agents Chemother 2006:50,1222 -
ABERNETHY DR al: Obesity, sex and Acetaminophen disposition.
Clin Pharmacol Ther 1982:31,783 -
ABERNETHY DR, GREENBLATT DJ: Phenytoin disposition in obesity, Determination of loading dose.
Arch Neurol 1985:42,468 -
ABERNETHY DR, GREENBLATT DJ: Drug disposition in obese humans. An update.
Clin Pharmacokinet 1986:11,199 -
ABERNETHY DR, SCHWARTZ JB: Verapamil pharmacodynamics and disposition in obese hypertensive patients.
J Cardiovasc Pharmacolo 1988:11,209 -
BAZINET A 6 al: Dosage of Enoxaparin among obese and renal impairment patients.
Thromb Res 2005;116,41 -
CASATI A, PUTZU M: Anesthesia in the obese patient: pharmacokinetic considerations.
J Clin Anesth 2005:17,134 -
CHRISTOFF PB al: Procainamide disposition in obesità.
Drug Intell Clin Pharm 1983:17,516 -
20) DVORCHIK BH, DAMPHOUSSE D: The pharmacokinetics of Daptomycin in moderately obese, morbidly obese, and matched non obese subjects.
J Clin Pharmacol 2005:45,48 -
FLECHNER SM al: The impact of body weight on Cyclosporine pharmacokinetics in renal transplant recipients.
Transplantation 1989:47,806 -
FLEMING RA al: Disposition of high-dose Methotrexate in an obese cancer patient
Cancer 1991:68,1247 -
GREEN B, DUFFULL B: Development of a dosing strategy for Enoxaparin in obese patients.
Br J Clin Pharmacol 2003:56,96 -
HOLMES G al: Pharmacokinetics of insulin aspart in obesity, renal impairment, or hepatic impairment.
Br J Clin Pharmacol2005:60,469 -
HOLMES G al: Pharmacokinetics of insulin aspart in obesity, renal impairment, or hepatic impairment.
Br J Clin Pharnacol 2005:60,469 -
26) KELLEY M al: Change in oral absorption of Tacrolimus in a liver transplant recipient after reversal of jejunoileal bypass: case report.
Transplant Proc 2005:37,3165 -
LUCAS RA: The human pharmacology of Fluoxetine.
Int J Obes Relat Metab Disord 1992:16,S49 -
MALONE M: Altered drug disposition in obesity and after bariatric surgery.
Nutr Clin Pract 2003:18,131 -
MILSAP RL al: Prednisolone disposition in obese men.
Clin Pharmacol Ther 1984:36,824 -
MORGAN DJ, BRAY KM: Lean body mass as a predictor of drug dosage. Implications for drug therapy.
Clin Pharmacokinet 1994:26,292 -
NAVARRO WH: Impact of obesity in the setting of high-dose chemotherapy.
Bone Marrow Transplantation 2003:31,961 -
POWIS G al:Effect of body weight on the pharmacokinetics of Cyclophosphamide in breast cancer patients.
Cancer Chemother Pharmacol 1987:20,219 -
RODVOLD KA & al: Doxorubicin clearance in the obese.
J Clin Oncol 1988:6,1321 -
SANTINI F & al: Lean body mass is a major determinant of Levothyroxine dosage in the treatment of thyroid disease.
J Clin Endocrinol Metab 2005:90,124 -
SCWARTZ AE & al: Pharmnacokinetics and pharmacodynamics of Vecuronium in the obese surgical patient.
Anesth Analg 1992:74,515 -
STEIN GE & al; Pharmacokinetics and pharmacodynamics of Linezolid in obese patients with cellulitis.
Ann Pharmacother 2005:39,427 -
SUN YN & al: Population pharmacokinetics of Efazulimab (humanized monoclonal anti-CD11a antibody) following long-term subcutaneous weekly dosing in psoriasis Subjects.
J Clin Pharmacol 2005:45,468 -
VANCE-BRYAN K % al: Effect of obesity on Vancomycin pharmacokinetic parameters as determined by using a bayesian forecasting technique.
Antimicrob Agents Chemother 1993:37,436 -
WOJCICKI J & al; Comparative pharmacokinetics and pharmacodynamics of Propranonol and Atenolol in normolipaemic and hyperlipidaemic subjects.
Biopharm Drug Dispos 2003:24,211 -
WOLTZ M & al: Pharmacokinetics and pharmacodynamics of Ximelagatran.
Semin Vasc Med 2005:5,245











.png)





