RILIEVI STORICO RELAZIONALI DELLA METFORMINA (GLUCOPHAGE) CON IL CANCRO
Le evidenze sinora accumulate dimostrano che il diabete si associa con una maggiore frequenza del normale alle malattie neoplastiche maligne. In particolare, quello di tipo 1 comporta un eccesso del rischio intorno al 20%. Quello di tipo 2, invece, che interessa maggiormente la popolazione adulta ed è associato quasi obbligatoriamente con l'obesità e con la resistenza all’insulina, ha dimostrato un aumento del rischio del carcinoma del colon, del pancreas e in postmenopausa della mammella.
In USA l’eccesso del rischio del cancro del colon è stato stimato intorno al 30%, quello del pancreas di circa il 50% e quello della mammella intorno al 20%. La possibilità di un'associazione tra insulina e cancro ha, peraltro, attirato l'interesse della ricerca scientifica dal momento che i tumori della mammella, del colon e del pancreas sono stati tutti associati con gli aumentati livelli circolanti dell’insulina endogena nella popolazione non diabetica. Questo potrebbe spiegare alcune delle sovrapposizioni del rischio di cancro nel diabete, nell’obesità e in altre condizioni associate alla resistenza all'insulina.
Agli inizi del secolo scorso erano, in effetti, già riconosciuti i legami tra i disturbi del metabolismo cellulare intrinseci al rapporto diabete - cancro.
Una delle caratteristiche delle neoplasie maligne è, peraltro, la riprogrammazione del metabolismo energetico per la crescita e la divisione cellulare.
Pur tuttavia già nel 1885, si poneva l’attenzione alla relazione che compariva nei malati di cancro con l’iperglicemia spontanea, ma il problema dell’associazione tra l’alterato metabolismo dei carboidrati e la neoplasia generava solo un interesse sporadico e delle polemiche infruttuose.
In conformità a tali premesse, Arvin S Glicksman del Memorial Center for Cancer and Allied Diseases, New York e collaboratori intraprendevano uno studio al MemoriaI Center per determinare la frequenza del diabete nella popolazione affetta da cancro.
Gli Autori confrontavano questo tipo di pazienti con altri, come gruppo di controllo, affetti da patologie benigne, (Cancer, vol. 9, pp. 1127–1134, 1956).
Sulla base dei 950 casi riportati, la loro indagine faceva concludere che l’alterato metabolismo dei carboidrati, come nel caso del diabete conclamato, sembrava associarsi significativamente con una neoplasia maligna.
L’analisi storica di quest’associazione faceva rilevare, in primis, il rapporto originale di Freund E. dell’iperglicemia in sessantadue su settanta pazienti con il cancro (Wien. med. Bl. 8: 268–269, 1885).
Cinque anni dopo, Trinkler N. confermava l’osservazione e concludeva che il sangue dei pazienti oncologici mostrava, in generale, una percentuale relativamente grande di sostanze riducenti e, in particolare, di glucosio. Tale dato era quello maggiormente correlato al cancro del sistema digestivo, piuttosto che a quello della pelle o delle mucose (Centralbl. f. d. med. Wissensch. 28: 498–500, 1890).
Tuffier riassumeva il pensiero generale del problema, rilevando la non rara, ma certamente non uniforme, simultaneità dell’occorrenza del cancro nel diabete. Affermava che in generale il diabete precedeva la condizione e che la neoplasia erta da considerarsi secondaria. Erano riportati, comunque, casi in cui la neoplasia appariva per prima. Era, peraltro, opinione comune che in questa situazione la neoplasia progredisse più rapidamente, mentre la glicosuria e l’iperglicemia tendessero a scomparire (Arch. gén. de méd. 2: 129–140; 314–336, 1888).
Quando si affermò la validità della curva di tolleranza al glucosio come misura diagnostica, Edwards S. riferiva che essa aveva valore come metodo per eliminare la possibilità di diagnosi del cancro, piuttosto che come dimostrazione della sua presenza. Egli, peraltro, confermava di aver trovato una tipica curva in tutta la serie di malignità (J. Indiana M. A. 12: 296–298, 1919).
Dal suo canto, Langston W. in un'analisi di 154 casi, suggeriva che il metabolismo dei carboidrati era disturbato dalla crescita del cancro, apparentemente nello stesso modo dei disturbi endocrini. Pur tuttavia, non riusciva a definire una caratteristica curva di tolleranza al glucosio per i malati (J. Lab. & Clin. Med. 7: 293–298, 1922).
Kelly T. C. concludeva che la curva di tolleranza al glucosio era di suggestivo valore ma solo come esclusivo ausilio per la diagnosi clinica del cancro (Am. J. M. Sc. 169: 216–224, 1925).
Sulla scia dei continui studi, un altro aspetto di questo problema, che attirò l'attenzione dei primi investigatori, riguardava l’effetto della terapia sul metabolismo alterato dei carboidrati.
Slosse A. e Reding R. nella loro rassegna sull’iperglicemia dei pazienti con lesioni tumorali e precancerose rilevavano che la radioterapia produceva un profondo e duraturo effetto sulla regolazione dello zucchero nel sangue (Bull. Acad. roy. de méd. de Belgique 7: 405–435; disc. 435–438, 1927).
Jacobson P. H. scopriva che i pazienti con normali curve di tolleranza al glucosio, affetti da cancro, miglioravano quando trattati con la chirurgia o la radioterapia. Invece, quelli con curve anormali di tolleranza al glucosio avevano una maggiore tendenza alla recidiva (J. Med. 24: 622–626; disc. 626–629, 1929).
Tuttavia, Theis R. C. e Stone, W. S non trovavano alcuna relazione tra la sensibilità della malattia alla terapia e i maggiori livelli di zucchero nel sangue (Centralbl. f. d. med. Wissensch. 28: 498–500, 1890).
Da allora si sono susseguiti molte ricerche che hanno indicato un aumento significativo dell’incidenza del cancro nei diabetici.
Marble A, nel rivisitare l'esperienza della Baker Clinic, trovava 256 casi di cancro in 10.000 diabetici (New England J. Med. 211: 339–349, 1934).
Il gruppo di Joslin E. P. segnalava per tutti i decessi tra i diabetici un aumento dell'incidenza del cancro come causa di morte dall’1,5 per cento del 1900 allo 8,9 per cento del 1940.
Concludeva, quindi, che tutto ciò dipendeva dalla maggiore longevità del diabetico dall'inizio dell’era insulinica (8th ed. Philadelphia. Lea & Febiger. 1946).
Tuttavia, Robin A. aveva già riferito che l’8,3 per cento dei suoi pazienti diabetici era morto per cancro nell'era proinsulina del 1917 (Bull. Acad. de néd., Paris 77: 481–486; disc. 486–488, 1917).
Dal loro canto, Marble A. (New England J. Med. 211: 339–349, 1934), McKittrick L. S. e Root H. F. (Lea & Febiger. 1928) e Inglefinger, F. J. (New England J. Med. 235: 653–661, 1946) avevano riportato che il cancro del pancreas nei diabetici raggiungeva valori dal 13 e al 32 per cento, rispetto alla frequenza di circa il 3,5 per cento della popolazione totale.
Pur tuttavia, nella letteratura mondiale molti studi, basati sul materiale autoptico, dimostravano che la combinazione diagnostica di cancro e diabete non era aumentata significativamente.
Jacobson P. H., comunque, pubblicava in seguito uno studio statistico del cancro tra i diabetici, paragonando il tasso generale di morte per cancro nel Massachusetts con quello rilevato fra i diabetici alla Baker Clinic. I diabetici presentavano almeno un terzo in più di morti per cancro di quanto ci si sarebbe aspettato nello Stato del Massachusetts dal 1928 al 1938. Così, l’Autore concludeva che vi era effettivamente un rapporto reale tra il diabete e il cancro (Milbank Mem. Fund Quart. 26: 90–118, 1948).
Erika L Pearce dell’University of Pennsylvania School of Medicine, USA e collaboratori dopo somministrazione della metformina ottenevano un risanamento della generazione della FAO (fatty acid oxidation) e del CD8 TM in assenza di TRAF6. Sorprendentemente questo trattamento aumentava anche i CD8 TM nei topi wild type e, di conseguenza, era in grado di migliorare, in modo significativo, l'efficacia di un vaccino sperimentale anti-cancro (Nature. 2009 Jul 2; 460(7251): 103–107).
I presupposti dello studio poggiavano sul fatto che le cellule CD8 T, con ruolo cruciale nell’immunità alle infezioni e nel cancro, erano mantenute in numero costante. Sotto stimolazione degli antigeni, invece, erano sottoposte a un programma di sviluppo caratterizzato da fasi distinte, comprendente l'espansione e, quindi, la contrazione delle popolazioni TE (antigen-specific effector), seguita dalla persistenza delle cellule TM (long-lived memory). Peraltro, anche se questo modello prevedibile di risposte delle cellule T CD8 fosse stato ben definito, i meccanismi cellulari alla base che regolavano il passaggio alla TM rimanevano non ben spiegati.
Gli Autori dimostravano, quindi, che il TRAF6, proteina adattatrice nel TNFR (TNF-receptor) e nella superfamiglia IL-1R / TLR, regolava lo sviluppo delle CD8 TM, successivo all’infezione, modulando il metabolismo degli acidi grassi. Si dimostrava che i topi con delezione specifica delle cellule T del TRAF6 mostravano robuste risposte CD8 TE, ma con un profondo difetto nella loro capacità di generare TM, caratterizzato dalla scomparsa delle cellule antigene-specifiche nelle settimane seguenti l’immunizzazione primaria. Le tecniche di valutazione del trascrittoma (microarray) rivelavano che le cellule CD8 T, carenti di TRAF6, mostravano un’alterata espressione dei geni che regolavano il metabolismo degli acidi grassi. Coerentemente con tutto ciò, le cellule CD8 T attivate, prive del TRAF6, mostravano, in risposta alla soppressione del fattore della crescita, una difettosa attivazione dell’AMPK e della FAO (fatty acid oxidation) mitocondriale. La somministrazione della metformina restaurava la generazione del FAO e delle CD8 TM in assenza del TRAF6. Sorprendentemente, poi, questo trattamento aumentava anche le CD8 TM nei topi wild type. Di conseguenza, era in grado di migliorare in modo significativo l'efficacia di un vaccino sperimentale anti-cancro.
Josie M M Evans dell’University of Dundee e collaboratori, considerando la recente scoperta che la proteinchinasi LKB1 era a monte della
regolazione dell'AMPK, ipotizzavano che l'uso della metformina nei pazienti con diabete di tipo 2 potesse ridurre il rischio del cancro (BMJ 2005; 330:1304–1305)
In effetti, il LKB1 era un ben riconosciuto soppressore tumorale e l'attivazione dell’AMPK, determinata dalla metformina e dell’esercizio, richiedeva il LKB1. Ciò avrebbe ben spiegato anche perché l’esercizio potesse rappresentare il benefico ruolo primario e secondario nella prevenzione di alcuni cancri.
Gli Autori utilizzavano, così, i database sviluppati in Tayside, Scozia, su 314.127 persone residenti o decedute tra il 1993 e il 2001, di cui 11.876 di nuovo e 923 di successivo ricovero in ospedale. Si raccoglievano le informazioni circa l'uso della metformina per tutti i casi e i controlli e si consideravano le odds ratio aggiustate per i possibili fattori confondenti.
Più della metà dei pazienti con cancro (488; 53%) erano uomini. L'età media era 73 (deviazione standard 9.8) anni e la durata media del diabete era di 8,5 (6,4) anni. Più di un terzo (336; 36,4%) dei casi aveva avuto almeno una prescrizione di metformina nell'anno precedente la loro data indicata, rispetto ai 732 (39,7%) dei controlli.
L'odds ratio non aggiustato era 0,86 (intervallo di confidenza al 95% da 0,73 a 1,02). L'odds ratio non aggiustato per qualsiasi esposizione alla metformina dal 1993 era 0,79 (0,67-0,93). Si studiavano anche la durata totale di esposizione (tempo tra la prima e l'ultima prescrizione della metformina), il totale numero di prescrizioni e l'importo totale di metformina erogato dal gennaio 1993. La regolazione non influenzava particolarmente le stime del rischio, indicando l'assenza sostanziale degli effetti confondenti.
Prendendo in considerazione che la metformina potesse essere associata con un rischio ridotto di cancro nei pazienti con diabete di tipo 2 sulla base di un plausibile meccanismo biologico, gli Autori rilevavano come particolare interesse la possibile relazione dose-risposta. I punti di forza del loro studio erano, peraltro, basati sul campionamento della popolazione, sul metodo oggettivo utilizzato per definire l’esposizione alla metformina con dettaglio della storia prescrittiva dei farmaci erogati e la regolazione per i fattori confondenti.
Questo studio osservazionale, comunque, suggeriva per prima che l'uso della metformina era associato a un 23% di diminuzione del rischio di qualsiasi cancro.
Andrea DeCensi dell’Ospedali Galliera, Genoa - Italy e collaboratori eseguivano senza restrizioni una metanalisi di ricerca completa degli studi epidemiologici della letteratura fino al maggio del 2009 per valutare l'effetto della metformina sull’incidenza e la mortalità del cancro nei pazienti diabetici (Cancer Prev Res; 3(11); 1451–61. ©2010 AACR).
Le premesse dello studio poggiavano sul dato di fatto che nei paesi occidentali una gran parte di tutti i tumori era riconducibile allo stile di vita non salutare, caratterizzato dall’inattività fisica e dall’insorgenza precoce della sindrome metabolica, dell’insulino-resistenza con il diabete, delle malattie cardiovascolari e del cancro. Gli Autori annotavano, difatti, che l’iperinsulinemia incideva negativamente sulla prognosi oncologica e che rappresentava un fattore di rischio indipendente per diversi tipi di neoplasie. Si spiegava in tal modo, difatti, l'associazione tra l’obesità e il cancro. Peraltro l’'insulina poteva promuovere la tumorigenesi attraverso un effetto diretto sul tessuto epiteliale, agendo sulla famiglia dei recettori dei fattori di crescita insulinosimili, o indirettamente modificando i livelli di altri modulatori, come i fattori di crescita insulinosimili, gli ormoni sessuali e le adipochine. Le evidenze provavano che l'attività proliferativa anormalmente elevata delle cellule premaligne e di quelle neoplastiche richiedeva alti livelli di nutrienti per soddisfare le crescenti richieste di consumo energetico e di biosintesi proteica. Peraltro, le aberrazioni dei geni coinvolti nelle vie metaboliche, come ad esempio la via AMPK / LKB1, rappresentavano un segno distintivo di cancerogenesi emergente, sempre più utile a essere riconosciuto come plausibile bersaglio preventivo e terapeutico.
La metformina, farmaco di scelta per la gestione del diabete mellito di tipo 2, migliorando la resistenza all'insulina e il controllo glicemico, poteva, peraltro, essere tranquillamente combinata con altre classi di antidiabetici. La sua azione primaria d’inibizione della produzione epatica del glucosio, attraverso un meccanismo mediato LKB1 / AMPK, permetteva, di fatto, di migliorare nei tessuti periferici anche la sensibilità all'insulina.
Gli Autori selezionavano, così, undici studi d’indipendenza e di comunicazione dei dati d’incidenza e di mortalità, in termini di rilevanza d’intervento sulla popolazione. Riportavano, quindi, 4.042 eventi di cancro e 529 decessi correlati. In sintesi complessiva, nei soggetti che assumevano metformina, rispetto agli altri farmaci antidiabetici, si riscontrava una riduzione del 31% del rischio relativo (0.69; intervallo confidenza del 95%= 0,61-0,79).
L'associazione inversa era significativa per il cancro del pancreas e per quello epatocellulare. Non era significativa per il cancro del colon, della mammella e della prostata. Peraltro, si notava una tendenza a una relazione dose-risposta. La metformina, rispetto ad altri trattamenti, si associava a una diminuzione del rischio d’incidenza del cancro.
Rita Ferla della Temple University, Philadelphia, USA e collaboratori, nelle premesse che in modelli cellulari la metformina inibiva la crescita di molti tipi di cellule tumorali, analizzavano gli effetti del farmaco sulla crescita e la migrazione delle cellule LN18 e LN229 GBM (glioblastoma multi-forme), coltivate in condizioni basali o esposte alla leptina (Oncol Lett. 2012 Nov; 4(5): 1077–1081).
In particolare, gli effetti del farmaco sul GBM non erano ben caratterizzati e la leptina era stata già coinvolta nello sviluppo di questo tipo di neoplasia. Gli Autori riscontravano che la metformina 2-16 mM riduceva, in modo dose-dipendente, la crescita basale e quella stimolata dalla leptina nelle cellule GBM. Inoltre, il farmaco inibiva significativamente la migrazione delle cellule della neoplasia. L'azione del farmaco era mediata dalla sovraregolazione della sua molecola di segnalazione principale, l’AMPK (adenosine monophosphate-activated protein kinase), così come attraverso la sottoregolazione dello STAT3 (signal transducer and activator of transcription 3) e dell’Akt / PKB serina / treonina protein chinasi. Nelle cellule trattate con leptina, il farmaco invertiva gli effetti della citochina sulle vie AMPK e STAT3, ma modulava, in maniera dipendente dalle cellule, l’attività Akt.
In conclusione, i risultati suggerivano che la metformina, o agenti simili ad azione sull’AMPK, ottimizzando la penetrabilità della barriera emato-encefalica, avrebbero potuto avere un interesse di sviluppo come potenziali trattamenti del GBM ed essere utilizzati in combinazione con altri farmaci antagonisti dei recettori della leptina.
In effetti, studi in vivo hanno dimostrato che la metformina può, almeno in una certa misura, attraversare la barriera emato-encefalica attraverso un meccanismo di trasporto cationico organico-dipendente. Il farmaco può, così, esercitare i suoi effetti farmacologici, tra cui l'attivazione dell’AMPK sia nel cervello sano e sia nelle cellule del glioma in vitro. In particolare, il percorso AMPK sembra essere critico per la crescita del GBM, dipendente dal recettore del fattore di crescita epidermico. Così che, l'attivazione dell’AMPK, da parte del suo agonista, riduce significativamente la proliferazione della neoplasia.
A tale proposito, è bene ricordare che Klein J dell’University of Lübeck, Germany e collaboratori avevano già riportato: gli effetti della metformina sul metabolismo degli adipociti, la segnalazione e la secrezione della leptina in un modello di adipociti del grasso bruno (J Endocrinol. 2004 Nov;183(2):299-307).
Tutto ciò nelle premesse che il tessuto adiposo era riconosciuto come un importante organo endocrino d’importanza fondamentale per la regolazione della resistenza all'insulina e dell'omeostasi energetica. Grazie alla sua capacità termogenica, il tessuto adiposo bruno contribuisce, difatti, alla regolazione del metabolismo energetico ed è un interessante tessuto bersaglio per gli approcci farmacologici per il trattamento dell’insulino-resistenza e dell’obesità. La leptina, prototipo ormone di derivazione adipocitaria, induce, per suo conto, un bilancio energetico negativo. La metformina, per sua parte invece, stimola acutamente la MAP (mitogen-activated protein) p44 / p42 chinasi in dose (3,2 volte a 1 mmol / l, P <0,05) e tempo dipendente (3,8 volte a 5 min, P <0,05). Gli Autori riscontravano che questa stimolazione era altamente selettiva. Inoltre, il trattamento con metformina cronico per dodici giorni inibiva in modo dose-dipendente la secrezione della leptina dal 35% al 75%, rispettivamente con 500 mumol / l e un mmol / l (P <0,01). Peraltro, tale riduzione non era causata da alterazioni nella differenziazione degli adipociti e la perdita di valore della secrezione di leptina con la metformina era reversibile entro quarantotto ore dopo la rimozione del farmaco. L'inibizione farmacologica della p44 / p42 MAP chinasi impediva, di fatto, l'effetto negativo, indotto dalla metformina sulla secrezione di leptina.
In conclusione e nel loro insieme, i dati dimostravano effetti diretti, acuti della metformina sulla segnalazione degli adipociti e sulla funzione endocrina, con l'inibizione marcata della secrezione di leptina. Suggerivano, in tal modo, un meccanismo molecolare selettivo che poteva contribuire all'effetto anoressigeno e di altra natura di questo composto antidiabetico.
A tal proposito, è bene segnalare come in diversi studi la leptina e il suo recettore (OBR) siano emersi come importanti biomarcatori tumorali.
Hiroshi Noto del National Center for Global Health and Medicine, Tokyo, Japan e collaboratori, con l’obiettivo di aumentare la precisione delle stime degli effetti della metformina sul rischio di qualsiasi cancro nei pazienti con diabete, eseguivano una ricerca in letteratura sugli articoli pertinenti a partire dal 12 ottobre 2011 per inserirli in una revisione sistematica e in una meta-analisi (PLoS ONE, (2012: 7(3): e33411).
Gli Autori prendevano lo spunto dalle verifiche scientifiche sulle proprietà dell’iperinsulinemia e dell’iperglicemia nella promozione della carcinogenesi nei pazienti con diabete mellito. Difatti, diverse metanalisi avevano solo dimostrato che il diabete si associava a un aumentato rischio di tumori, come quello del seno, dell’endometrio, della vescica, del fegato, del colon-retto e del pancreas, ma anche a una diminuzione del rischio del cancro alla prostata. Le evidenze sul linfoma non-Hodgkin allo stato corrente erano inconcludenti.
Gli Autori calcolavan, così, gli RR (risk ratios) d’insieme della mortalità per il cancro in generale e della sua incidenza. Dei 21.195 pazienti diabetici segnalati in sei studi, di cui quattro di coorte e due RCT, 991, corrispondenti al 4,5%, erano quelli venuti a morte. Tra i 210.892 pazienti di dieci studi, di cui due RCT, sei studi di coorte e due caso-controllo, si rilevavano 11.117 casi, pari al 5,3%, di cancro di qualsiasi sede. Tra coloro che usavano la metformina, il rischio della neoplasia maligna era significativamente più basso di chi non la usava.
Gli Autori, sulla base della valutazione di qualità imposta alla loro revisione sistematica, includevano nella meta-analisi un totale di 24 articoli con informazioni sufficienti. In chi usava la metformina, i rischi di mortalità si dimostravano diminuiti in modo significativo per tutti i cancri, rispetto ai non utenti. In un'analisi di sensibilità, la stima d’insieme (IC 95%) tra gli studi di coorte osservazionale per tutte le mortalità per cancro era 0,62 (0,46-0,82), I2 = 56%, p = 0,08 e la stima tra gli RCT era 1,22 (0,36-4.11), I2 = 60%, p = 0.12. La differenza tra i record di risorse tra gli studi osservazionali e gli RCT non era statisticamente significativa (p = 0,35). Gli RR complessivi (con gli intervalli di confidenza 95%) erano 0,66 (0,49-0,88) per la mortalità per cancro, 0,67 (0,53-0,85) per l’incidenza di tutti i tipi di cancro, 0,68 (0,53-0,88) per i 6 tumori colorettali, 0,20 (0,07-0,59) per 4 carcinomi epatocellulari, 0,67 (0,45-0,99) per i 3 cancri polmonari. In particolare, tra gli studi di coorte osservazionale lo RR (IC 95%) per l'incidenza del cancro era 0,66 (0,49-0,88), I2 = 96%, p <0,00001. Quello complessivo tra gli studi caso-controllo era, invece, 0,38 (0,23-0,61 ), I2 = 3%, p = 0.31 e la stima tra gli RCT era 1,03 (0,82-1,31), I2 = 30%, p = 0.23. La differenza dei record di risorse tra gli studi osservazionali e gli RCT risultava statisticamente significativa (p = 0,019). Il rischio di cancro era significativamente diminuito per i tumori del fegato, del colon-retto e del polmone. Gli RR del cancro della prostata, del seno, del pancreas e dello stomaco non erano statisticamente significativi.
In conclusione, l'uso della metformina nei diabetici si associava a un rischio significativamente più basso di mortalità e d'incidenza del cancro.
Pur tuttavia, si osservava un’eterogeneità significativa nella maggior parte di queste analisi senza evidente bias.
Samy Suissa e Laurent Azoulay dello Jewish General Hospital, Montreal, Canada analizzavano i bias dipendenti dal tempo riguardo agli studi osservazionali sugli effetti della metformina nel diabete (Diabetes Care 35:2665–2673, 2012).
In effetti, queste condizioni tendono spesso a esagerare notevolmente i benefici osservati con un farmaco.
Gli Autori evidenziavano che questi bias, relativi al tempo, erano stati descritti e dimostrati importanti in studi osservazionali che avevano associato la metformina con una riduzione impressionante dell'incidenza e della mortalità per cancro. Di conseguenza il farmaco, come potenziale agente antitumorale, aveva riscosso, pur con la compatibilità di presenza dei bias temporali molta attenzione.
Gli Autori scoprivano che diversi studi osservazionali erano viziati da bias legati al tempo, portando a illusori effetti straordinariamente significativi con riduzioni del rischio di cancro dal 20 a 94%. Tre studi, che evitavano, invece, queste distorsioni, non avevano riscontrato nessun effetto sull’uso della metformina sull'incidenza del cancro.
In conclusione, gli Autori, pur ritenendo gli studi osservazionali importanti per capire meglio gli effetti dei farmaci, ribadivano che la loro corretta progettazione e analisi erano essenziali per evitare i gravi bias relativi al tempo. Per quanto riguardava la metformina, poi, l'evidenza scientifica dei suoi potenziali effetti benefici sul cancro, prima di ulteriori intraprendere lunghe e costosi studi, avrebbe avuto bisogno di essere rivalutata criticamente.
Zhang P della Shandong University, People's Republic of China e collaboratori, per valutare l'effetto dell'assunzione della metformina sull’incidenza e sulla mortalità del cancro, esaminavano gli articoli originali in lingua inglese, pubblicati in letteratura fino al 15 Giugno 2012 (Cancer Epidemiol. 2013 Jun;37(3):207-18).
La metanalisi calcolava gli SRR (summary relative risk) e i loro intervalli di confidenza al 95% (IC95%). Era condotta l'analisi di sensibilità per valutare la robustezza della stima d’insieme dei dati. Il rischio di bias di pubblicazione era valutato mediante il test di asimmetria di regressione di Egger.
Secondo i criteri di ammissibilità, trentasette studi, comprendenti 1.535.636 partecipanti, erano selezionati in termini d’intervento e dei dati d’incidenza del cancro o della mortalità. Tra i consumatori della metformina, rispetto ai non utilizzatori, la SRR per incidenza complessiva del cancro era 0,73 (IC 95%= 0,64-0,83) e per quella della mortalità 0,82 (IC 95%= 0,76-0,89). Le riduzioni del rischio dell'incidenza per il cancro del fegato, del pancreas, del colon-retto e del seno erano rispettivamente 78%, 46%, 23% e del 6%. Inoltre, la metformina poteva ridurre la mortalità del cancro al fegato (SRR, 0,23; IC 95%= 0,09-0,60) e al seno (SRR, 0.63; IC 95%= 0,40-0,99). Non si riscontrava alcuna associazione statisticamente significativa tra la metformina e l'incidenza del cancro alla prostata.
In conclusione, la metformina poteva ridurre l'incidenza globale del cancro e, in particolare, di quello al fegato, al pancreas, al colon-retto e alla mammella. Poteva anche diminuire la mortalità del cancro in generale e, in particolare, di quello al fegato e al seno. Nessun effetto benefico si dimostrava, invece, sull’incidenza del cancro della prostata.
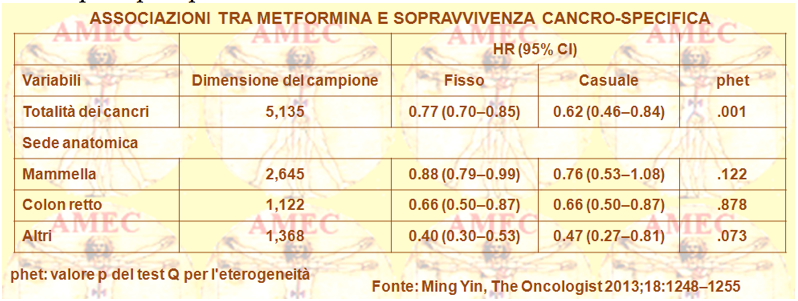
Ming Yin del Geisinger Medical Center, Danville, Pennsylvania, USA e collaboratori, sempre considerando che la metformina poteva ridurre il rischio di cancro e della mortalità correlata nel diabete di tipo 2, non ritenendo, per altro, chiaro se potesse anche modularne gli esiti clinici, hanno compiuto una meta-analisi (The Oncologist 2013;18:1248–1255).
Le venti pubblicazioni selezionate comprendevano 13.008 soggetti in cui era stata valutata in pazienti con cancro e concomitante diabete tipo 2 l'associazione tra la metformina e l’OS (overall survival), come pure la CSS (cancer-specific survival).
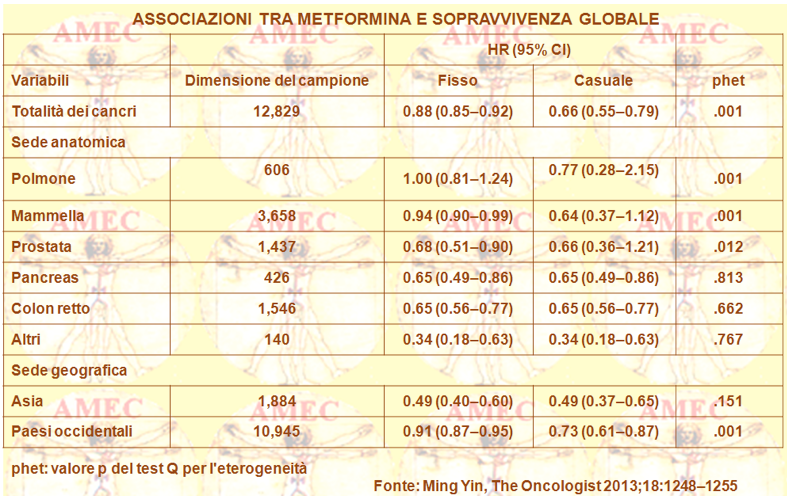
Gli Autori rilevavano un beneficio di sopravvivenza relativo, associato con il trattamento con metformina rispetto a quello con altri farmaci ipoglicemizzanti, in entrambe l’OS e il CSS (hazard ratio [HR]= 0,66; intervallo di confidenza [IC] 95%: 0.55 0.79 e HR= 0.62; IC 95%: 0,46-0,84, rispettivamente).
Peraltro, queste associazioni erano osservate anche nei sottogruppi di cancro per tipo e paese.
In conclusione, i risultati suggerivano che la metformina era il farmaco di scelta nel trattamento dei pazienti con cancro e concomitante diabete di tipo 2. In un modello di analisi fissa, stratificato per tipo di cancro, gli Autori scoprivano che la metformina si associava a una riduzione significativa del rischio di morte nei soggetti con cancro al seno, alla prostata, al pancreas, al colon-retto e in altra sede. Faceva eccezione il cancro polmonare. In modelli casuali di analisi, la metformina si associava a un significativo ridotto rischio di morte nei pazienti con cancro pancreatico, del colon-retto e con tumore in altra sede. Era non significativamente ridotto il rischio di morte nei soggetti con cancro del polmone, della mammella e della prostata.
Peiman Habibollahi dell’Harvard Medical School, Boston, MA e collaboratori, nell’ipotesi che il ruolo dell’AMPK, come sensore di energia cellulare centrale, risultasse con effetti opposti sulla captazione e la generazione del glucosio, suggerivano per il 18F-FDG (18. F]fluorodeoxyglucose) e il 18F-FLT (18F]fluorothymidine) funzioni diverse per la valutazione dell’efficacia della metformina come agente anti-neoplastico (J Nucl Med. 2013 February ; 54(2): 252–258).
Gli Autori trattavano, quindi, linee cellulari di cancro del colon HT29 (umane) e MC26 (murine) per ventiquattro o settantadue ore con una gamma di MET (0-10mm). Il Western blotting era utilizzato per studiare l'attivazione dell’AMPK dopo il trattamento TEM. L'assorbimento del glucosio e la proliferazione cellulare erano misurati con studi di ritenzione cellulare con il 18F-FDG o il 18F-FLT. Erano determinati i cambiamenti della fase S del ciclo cellulare e dell’apoptosi. In vivo erano acquisite le immagini 18F-FDG e 18F-FLT PET sui topi portatori di tumore HT29, prima e dopo ventiquattro ore del trattamento TEM.
Dopo ventiquattro ore d’incubazione MET, l’AMPK fosforilata aumentava più volte in entrambe le linee cellulari, mentre la totale rimaneva invariata. Negli studi di ritenzione delle cellule il 18F-FDG aumentava, mentre la ritenzione del 18F-FLT diminuiva significativamente in entrambe le linee cellulari. Le cellule in fase S, dopo terapia MET, diminuivano del 36% nelle HT29 e del 33% nelle MC26. L'apoptosi aumentava rispettivamente di 10.5 × e di 5.8 × nelle HT29 e nelle MC26 dopo 72 ore d’incubazione con il TEM. La PET dimostrava maggiore assorbimento del 18F-FDG (media SUV: 0,71 ± 0,03 e 1,29 ± 0,11 in pre e post terapia MET, p <0.05) e una diminuzione dell’assorbimento del 18F-FLT (media SUV: 1.18 ± 0.05 e 0.89 ± 0.01 in pre e
post terapia MET, p <0,05) nelle HT29 cellule tumorali dei topi.
In conclusione, la MET, attraverso l'attivazione del percorso AMPK, esercitava un aumento dose-dipendente dell’assorbimento del glucosio nel tumore, mentre diminuiva la proliferazione cellulare nel tumore del colon umano e murino. Così, i cambiamenti nel 18F-FDG, dopo trattamento TEM, potevano essere fuorvianti. L’imaging 18F-FLT si proponeva come un'alternativa promettente che correlava con la risposta del tumore.
Bindiya Thakkar dell’Harvard Medical School, Boston, MA, USA e collaboratori, sempre sulla base dell’accumulo di evidenze che suggerivano l’aumentato rischio di sviluppare tumori maligni nei pazienti con diabete di tipo 2 e nell’iperinsulinemia, eseguivano una meta-analisi per chiarire l’influenza della metformina nei meriti (Metabolism, Vol 62, Issue 7, July 2013, P 922–934).
L’analisi di ventiquattro studi sulla metformina in soggetti con diabete di tipo 2 dimostrava che il suo uso si associava con un rischio ridotto di sviluppo del cancro, sia in studi di coorte (RR = 0,70 [IC 95% = 0,67-0,73]) e sia in quelli caso-controllo (OR = 0.90 [IC 95% = 0,84-,98]). Questo risultato, però, non era supportato dagli RCT (RR = 1,01 [IC 95% = 0,81-1,26]). I dati di diciotto trial sulle sulfoniluree nei soggetti con diabete di tipo 2 dimostrava che il loro uso si associava a un aumento del rischio totale di cancro negli studi di coorte (RR = 1,55 [IC 95% = 1,48 -1,63]). Ciò nonostante che i dati degli RCT (RR = 1.17 [IC 95% = 0,95-1,45]) e degli studi caso-controllo (OR = 1,02 [IC 95% = 0,93-1,13]) non avessero dimostrato un effetto statisticamente significativo.
In conclusione, quest’analisi, usando i dati primari d’insieme, dimostrava che l'uso della metformina riduceva il rischio di cancro nei soggetti con diabete di tipo 2, mentre quello della sulfonilurea poteva aumentarlo.
Ida Pernicova e Márta Korbonits della Queen Mary University of London in un loro articolo discutevano ampiamente sulla comprensione aggiornata dell'azione antigluconeogenica della metformina nel fegato e delle implicazioni sul trattamento del diabete mellito e del cancro (Nature Reviews Endocrinology 2014, Vol 10, P 143–156).
Z.-J. Zhang della Wuhan University, Hubei, China e collaboratori nella loro ricerca bibliografica selezionanavo ventotto studi dimostrando che la metformina nei pazienti oncologici con diabete concomitante si associava a un minor rischio di mortalità per qualsiasi causa (Diabetes, Obesity and Metabolism Volume 16, Issue 8, pages 707–710, August 2014).
In particolare, il dato era rilevante per il cancro al seno [rischio relativo cumulativo (RR) 0,70, IC 95%= 0.55, 0.88; p = 0.003], per quello del colon-retto (RR 0,70, IC 95%= 0,59, 0,84; p <0,001), dell'ovaio (RR 0.44, IC 95%= 0.30, 0.64; p <0.001) e dell’endometrio (RR 0,49, IC 95%= 0.32, 0.73; p = 0.001). Inoltre, la metformina si associava a minori rischi di mortalità cancro-specifica.
In conclusione, i risultati supportavano l'ipotesi che la metformina migliorava la sopravvivenza dei pazienti diabetici con cancro concomitante, in particolare del seno, del colon, delle ovaie e dell’endometrio.
Hua Xu dell’University of Texas School of Biomedical Informatics at Houston, USA e collaboratori costruivano dal 1995 al 2010 una coorte di 32.415 adulti con diagnosi di cancro della Vanderbilt University Medical Center e 79.258 della Mayo Clinic, due ampie EHR (electronic health records).
Con l’utilizzo di metodi informatici automatizzati, gli Autori identificavano più precisamente i diabetici di tipo 2 all'interno della coorte del cancro ed estratto le informazioni di esposizione al farmaco, così come altre covariate, come il fumo (J Am Med Inform Assoc 2015; 22:179–191).
Si stimavano, quindi, gli HR per la mortalità e gli associati IC al 95%, utilizzando i modelli stratificati del rischio proporzionale di Cox. Gli HR erano stimati in rapporto all'esposizione alla metformina, aggiustati per l'età al momento della diagnosi, al sesso, alla razza, all’indice di massa corporea, all'uso del tabacco e d’insulina, al tipo di cancro e non cancro, all’indice di comorbidità di Charlson.
Tra tutti i malati di cancro del Vanderbilt la metformina si associava, rispetto ad altri farmaci ipoglicemizzanti orali, a una diminuzione del 22% della mortalità generale (HR 0,78; IC 95%= 0,69-0,88) e con una diminuzione del 39% rispetto ai diabetici di tipo 2 con sola insulina (HR 0,61; IC 95%= 0,73 a 0:50). I pazienti diabetici con metformina, quindi, avevano, rispetto ai non diabetici, una sopravvivenza migliore del 23% (HR 0,77; IC 95%= 0,71-,85). Utilizzando i dati EHR della Mayo Clinic, queste associazioni si replicavano. Molti tumori specifici per sede, compresi quello al seno, al colon-retto, al polmone, alla prostata, dimostravano con l'uso della metformina in almeno un EHR una riduzione della mortalità.
In conclusione, i dati EHR suggerivano che l'uso della metformina, dopo una diagnosi di cancro, si associava a una diminuzione della mortalità rispetto ai diabetici e ai non affetti da cancro senza il farmaco. Ciò indicava il suo potenziale effetto come chemioterapico.
Selene Capitanio dell’University of Genoa, Italy e collaboratori nella loro pubblicazione ribadivano la crescente evidenza antitumorale della metformina. In effetti, possibili meccanismi di azione sembravano per gli Autori indipendenti dal suo effetto ipoglicemico, coinvolgendo l'interferenza con le vie principali della proliferazione cellulare e della glicolisi (World J Radiol 2015 March 28; 7(3): 57-60).
Il crescente utilizzo della FDG-PET (18F-2-fluoro-2-deoxyd-glucose positron emission tomography) nella valutazione del cancro sollevava una serie d’interrogativi circa la possibile interferenza della biguanide sulla distribuzione FDG.
In particolare, le interferenze, esercitate dalla metformina sul percorso del sensore cellulare di energia AMP-activated proteinchinasi, sui livelli d’insulina e sull’esochinasi, potrebbero avere potenzialmente ripercussioni sulla gestione del glucosio e, quindi, sulla distribuzione della FDG.
In questa impostazione secondo gli Autori, per ottimizzare l'uso della PET sarebbe stata necessaria una migliore comprensione dell’impatto della metformina sulla FDG. Questa valutazione sarebbe stata, difatti, utile per migliorare l’interpretazione delle scansioni nei pazienti diabetici in trattamento cronico con metformina e per interpretare criticamente le immagini nel contesto dei trial clinici. Inoltre, la raccolta dei dati prospettici sarebbe stata di aiuto in questa impostazione per la verifica della PET come valido strumento per apprezzare l'effetto antitumorale di questo nuovo approccio terapeutico.











.png)





