Scompenso cardiaco: dalla terapia farmacologica a quella “elettrica”
Augusto Achilli*, Paola Achilli**
* Specialista in Malattie dell'Apparato Cardiovascolare ed in Gerontologia e Geriatria.
Già Dirigente Cardiologo - Ospedale di Belcolle di Viterbo.
Docente di Cardiologia - Università Cattolica del Sacro Cuore di Roma.
** Specialista in Cardiologia.
Dirigente Cardiologa - Ospedale di Belcolle di Viterbo.
Lo scompenso cardiaco (SC) è una complessa sindrome clinica a genesi polifattoriale caratterizzata da un’incapacità del cuore ad adattarsi alle modificazioni delle richieste metaboliche dell’organismo, e sostenuta da modificazioni emodinamiche e di diversi sistemi neuro ormonali, nella quale i sintomi legati alla ridotta capacità funzionale ed alla ritenzione idrosalina si manifestano in maniera sempre più severa, accompagnandosi ad una ridotta aspettativa di vita.
Tale sindrome può essere dovuta a patologie del pericardio, del miocardio, delle valvole cardiache o dei grandi vasi, ma la maggior parte dei pazienti con SC presenta ridotta funzionalità del ventricolo sin, anche se ampio è lo spettro di alterazioni della funzionalità ventricolare sinistra, che vanno da una predominante disfunzione sistolica con camere cardiache dilatate e ipocinetiche, ma con normale capacità di riempimento diastolico, ad una predominante disfunzione diastolica con camere cardiache e gittata normali ma alterato riempimento. Nella maggior parte dei pazienti coesitono alterazioni sistoliche e diastoliche. Il principale marker della disfunzione sistolica è la ridotta frazione di eiezione (FE) del ventricolo sinistro, di solito inferiore al 50%, mentre nei pazienti con alterata funzione diastolica sono compromessi gli indici ecocardiografici di riempimento ventricolare. L’incidenza dello SC a funzione sistolica conservata aumenta con l’età; in studi di comunità nel 40% dei casi è presente uno SC con isolata disfunzione diastolica (1).
Dal punto di vista sintomatologico e funzionale, lo SC è classificato dalla New York Heart Association (NYHA) in quattro classi di gravità progressiva sulla base della tolleranza allo sforzo fisico e della sintomatologia dispnoica (Tab. 1).
|
Classe NYHA I |
Nessuna limitazione. L’attività fisica ordinaria non causa indebita fatica, dispnea o palpitazioni (disfunzione ventricolare sinistra asintomatica) |
|
Classe NYHA II |
Lieve limitazione dell’attività fisica. Asintomatici a riposo, i pazienti presentano faticabilità, cardiopalmo o dispnea durante l’attività fisica ordinaria |
|
Classe NYHA III |
Marcata limitazione dell’attività fisica. Asintomatici a riposo, diventano sintomatici per attività fisica lieve (Insufficienza cardiaca moderata) |
|
Classe NYHA IV |
Impossibilità di effettuare qualsiasi attività fisica senza sintomi. I sintomi sono presenti anche a riposo e peggiorano con qualsiasi attività fisica (Insufficienza cardiaca severa) |
Tabella 1: Classificazione funzionale NYHA dello SC.
Epidemiologia
Numerosi dati epidemiologici e clinici evidenziano come lo SC stia diventando una delle più diffuse malattie cardiovascolari. Ciò è dovuto fondamentalmente a tre fattori, il primo rappresentato dal progressivo invecchiamento della popolazione, infatti è proprio tra gli anziani che lo SC è più frequente, il secondo dalla riduzione della mortalità per eventi acuti cardiovascolari, in primis l’infarto miocardico, ed il terzo dal miglioramento della terapia dello SC stesso. In definitiva una popolazione sempre più anziana e sopravvissuta ad eventi cardiaci acuti che compromettono anche gravemente la funzione cardiaca è sempre più frequentemente predisposta a sviluppare la sindrome SC. Paradossalmente la maggiore efficacia del trattamento di malattie cardiovascolari croniche, quali la cardiopatia ischemica e l’ipertensione arteriosa ed altre patologie quali il diabete mellito, ha l’effetto di posticipare, piuttosto che prevenire la comparsa dello SC.
Attualmente la prevalenza dello SC è compresa tra il 3 ed il 20 per 1000 nella popolazione generale e supera il 10% tra gli ultra sessantacinquenni. L’incidenza annuale è compresa tra l’uno ed il 5 per mille, ed approssimativamente raddoppia per ogni decade di età al di sopra dei 45 anni. Tutto ciò comporta un notevole aggravio per i vari sistemi assistenziali in termine di giornate di ricovero, visite ambulatoriali ed esami strumentali e si traduce in un aumento notevole dei costi di assistenza. In effetti, in vari paesi europei ed americani lo SC comporta una spesa complessiva tra l’uno ed il 2% della spesa sanitaria globale dello Stato. Paradigmatici sono i dati relativi agli Stati Uniti: circa 5.000.000 di persone sono affette da SC; ogni anno vengono diagnosticati 550.000 nuovi casi di malattia con una mortalità di 287.000 persone per anno; nel 2006 il costo stimato attribuibile alla malattia è stato di 29,6 miliardi di dollari.
Ma la problematica più pressante è quella che riguarda il paziente affetto dalla sindrome in termini di sintomatologia e possibilità di sopravvivenza. In effetti lo SC è ancora oggi una patologia che incide in maniera molto sfavorevole sulla qualità della vita dei pazienti e ad elevatissima mortalità, e ciò nonostante il fatto che i risultati di importanti studi clinici abbiano fornito la dimostrazione di un miglioramento della prognosi ottenuta con la somministrazione di farmaci ACE-inibitori, beta-bloccanti e spironolattone. A tale riguardo è importante sottolineare una vistosa discrepanza esistente tra i dati prognostici derivanti dai grandi studi clinici randomizzati, che riportano un tasso di mortalità annua media intorno al 15%, e quelli derivanti dagli studi di popolazione o dai “registri”, che segnalano invece dati di mortalità annua ben superiori al 30%. In particolare un’analisi della popolazione seguita nello studio di Framingham, volta a valutare le variazioni del trend di incidenza e di mortalità per SC in un intervallo di tempo di 50 anni (dagli anni ’50 ai ’90), ha evidenziato una riduzione di mortalità significativa, ma scarsamente rilevante dal punto di vista clinico (2) (Fig. 1). In pratica, in 50 anni la probabilità di sopravvivenza per SC è aumentata di circa 1 anno tra gli uomini e di circa 18 mesi tra le donne (2).

Figura 1: Probabilità di sopravvivenza in pazienti affetti da SC nello studio Framingham.
Nell’arco di circa 50 anni la durata di vita risulta prolungata di circa un anno tra gli uomini e circa 18 mesi tra le donne. (Da Lewy D. Ref. 2, modificata).
La prognosi non risulta pertanto migliorata in maniera sostanziale in un arco di tempo di 40-50 anni, così come avremmo potuto attenderci quale conseguenza dell’impiego di nuove, efficaci, terapie. A tale proposito sono preoccupanti i dati di uno studio pubblicato nel 2000 e condotto in Scozia; su una popolazione di oltre 66.000 pazienti dimessi dall’ospedale con diagnosi di SC si è osservata una mortalità del 44,5% ad un anno (3). Negli Stati Uniti, una statistica più recente riporta, in pazienti con nuova diagnosi di SC, una percentuale di mortalità del 28% ad un anno e del 65% a cinque anni. Per apprezzare meglio tali cifre si tenga presente che negli USA la sopravvivenza a cinque anni, nello stesso periodo di tempo, per tutte le forme di cancro era di circa il 50%.
La causa della morte nello SC è legata per circa il 40% dei casi a morte improvvisa, per lo più aritmica, per il 40% a progressione della disfunzione ventricolare sinistra, che evolve in un quadro clinico di bassa portata circolatoria, e per il restante 20% ad altre cause correlate alla sindrome (tromboembolie, insufficienza renale, cachessia, ecc.).
Per quanto riguarda la sintomatologia soggettiva, occorre ricordare come lo SC sia considerata la patologia internistica cronica che condiziona la peggiore qualità di vita così come viene percepita dai pazienti; ciò è particolarmente vero nei soggetti che si trovano in classe funzionale IV che presentano dispnea anche a riposo ed una intolleranza quasi assoluta all’esecuzione di qualsiasi esercizio fisico.
Fisiopatologia
Lo SC è la conseguenza di alterazioni che interessano una qualsiasi di quelle che sono le fisiologiche determinanti della portata cardiaca (Fig. 2).

Figura 2: Determinanti fisiologiche della portata cardiaca
Sia che si tratti di scompenso primariamente sistolico o primariamente diastolico, e qualunque sia il ventricolo coinvolto, si possono avere diversi adattamenti emodinamici, renali e neuro-ormonali che, nel breve periodo sono finalisticamente utili, ma nel lungo periodo innestano un circolo vizioso che tende inevitabilmente a peggiorare la funzione ventricolare (Fig. 3).
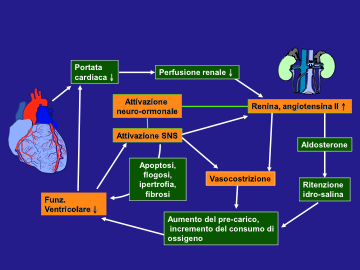
Figura 3: Conseguenze emodinamiche dell’attivazione neuro-ormonale nello SC
Adattamenti emodinamici: l'aumento della frequenza cardiaca e della contrattilità miocardica, la costrizione arteriolare in alcuni distretti, la venocostrizione e la ritenzione di Na e acqua costituiscono inizialmente meccanismi compensatori per la ridotta funzione ventricolare. Effetti negativi controproducenti di questi meccanismi compensatori comprendono l'aumento del lavoro cardiaco, la riduzione del flusso coronarico, l'aumento del precarico e del postcarico, la ritenzione di liquidi che provoca congestione, la perdita di miociti, l'aumento dell'escrezione di K e le aritmie cardiache.
Adattamenti renali: i meccanismi attraverso cui un paziente asintomatico con una disfunzione cardiaca sviluppa uno SC progressivo non sono noti, ma tutto comincia dalla ritenzione renale di Na e acqua secondaria alla ridotta perfusione renale. Così, a mano a mano che la funzione cardiaca peggiora, il flusso ematico renale diminuisce in maniera direttamente proporzionale alla riduzione della portata cardiaca e il flusso ematico all'interno dei reni viene redistribuito. La frazione di filtrazione e il Na filtrato si riducono, ma il riassorbimento tubulare aumenta.
Adattamenti neuro-ormonali: l'aumentata attività del sistema renina-angiotensina-aldosterone influisce sugli adattamenti renali e vascolari periferici nello SC. L'intensa attivazione simpatica che accompagna lo SC stimola il rilascio di renina da parte dell'apparato iuxtaglomerulare situato vicino alla parte discendente dell'ansa di Henle. La stimolazione del sistema renina-angiotensina-aldosterone (conseguente ai meccanismi ora descritti, ma anche secondaria alla stimolazione adrenergica) provoca una cascata di effetti potenzialmente dannosi: l'aumento dei livelli di aldosterone aumenta il riassorbimento di Na a livello del nefrone distale, contribuendo alla ritenzione di liquidi. La renina prodotta dal rene interagisce con l'angiotensinogeno, dando luogo all'angiotensina I, a partire dalla quale ha origine l'octapeptide angiotensina II per intervento dell'enzima convertente l'angiotensina (Angiotensin Converting Enzyme, ACE). L'angiotensina II ha diversi effetti che si ritiene peggiorino la sindrome dello SCC, compresi: la stimolazione del rilascio di arginina-vasopressina, ossia l'ormone antidiuretico (ADH); la vasocostrizione; l'aumento del rilascio di aldosterone; la vasocostrizione dell'arteriola efferente del glomerulo; la ritenzione renale di Na; l'aumento del rilascio di noradrenalina. Si ritiene anche che l'angiotensina II sia coinvolta nell'ipertrofia delle pareti dei vasi sanguigni e del miocardio, così da contribuire al rimodellamento del cuore e dei vasi periferici, che aggrava la sindrome dello SC in diverse patologie miocardiche e anche in altre cardiopatie.
I livelli di noradrenalina plasmatica sono aumentati in maniera significativa e riflettono in ampia misura l'intensa stimolazione nervosa simpatica, dal momento che i livelli di adrenalina plasmatica non sono aumentati. Elevati livelli plasmatici di noradrenalina nei pazienti con SC sono associati con una prognosi infausta.
Terapia dello SC
Il trattamento dello SC è stato più volte profondamente modificato negli ultimi anni dalle nuove conoscenze sulla fisiopatologia della malattia. Infatti, si è ormai passati da un approccio basato esclusivamente su farmaci “sintomatici” (digitale e diuretici) ad un intervento più razionale basato su farmaci che interagiscono con i meccanismi fisiopatologici coinvolti nel determinare la progressione della malattia (beta-bloccanti, inibitori del sistema renina-angiotensina-aldosterone), che si sono dimostrati efficaci non solo nel determinare un miglioramento della qualità di vita, ma anche di prolungare la sopravvivenza. Infine è stata introdotta una modalità di terapia “elettrica”, non farmacologica basata sull’utilizzo di defibrillatori impiantabili e di terapia di resincronizzazione cardiaca. Le varie modalità di trattamento vanno prese in considerazione, nel singolo paziente, in rapporto allo stadio della sindrome così come delineato nelle più recenti linee guida (4) (Fig. 4).
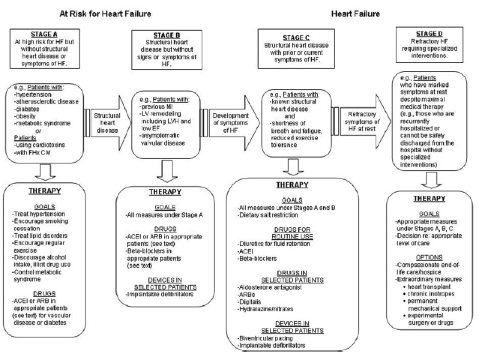
Figura 4: Stadiazione della progressione e trattamento delle SC (Linee guida AHA/ACC 2009) (Ref. 4)
Si va dalle misure preventive relative allo stadio A, alla terapia farmacologica classica (stadi B e C), alle procedure da intraprendere nelle fasi più avanzate o refrattarie della malattia (stadio D) che prevedono l’uso di inotropi non digitalici (Dopamina, Dobutamina, Amrinone, Levosimendan), vasodilatatori potenti (Nitroprussiato), procedure meccaniche (dialisi, ultrafiltrazione) e, nei casi estremi, l’utilizzo di assistenza ventricolare meccanica o il trapianto cardiaco.
La strategia globale del trattamento dello SC deve mirare a tre obiettivi fondamentali:
- Rallentare la progressione della malattia;
- Migliorare i sintomi e la qualità di vita;
- Prolungare la sopravvivenza.
Trattamento farmacologico.
Glicosidi digitalici.
Si tratta di un gruppo di sostanza per le quali è stata riconosciuta l’efficacia clinica in pazienti affetti da SC da oltre 200 anni, quando nel 1785 Withering descrisse le proprietà farmacologiche delle foglie di digitale in pazienti affetti da idropisia. Mentre è accertata l’utilità dei digitalici nei riguardi del miglioramento dei sintomi e della qualità di vita del paziente scompensato, sono ancora dubbi i risultati circa la capacità di migliorare la prognosi. Il più importante studio clinico al riguardo, il DIG Trial, ha evidenziato che la digossina non è in grado di ridurre la mortalità totale, ma riduce le percentuali di riospedalizzazione (5). Ciò è in parte dovuto al ristretto range terapeutico delle concentrazioni ematiche di tali sostanze che favorisce fenomeni di tossicità potenzialmente pericolosi. Ma i limiti dei digitalici derivano, come per tutti i farmaci inotropi positivi, dal loro meccanismo d’azione che si esplica aumentando la contrattilità delle fibre miocardiche, effetto questo che tende inevitabilmente ad aumentare la mortalità. La somministrazione dei digitalici è comunque indicata dalle linee guida per i pazienti nello stadio C.
Diuretici.
L’impiego dei diuretici dell’ansa, associato alla restrizione dell’introduzione di sodio, è fondamentale nei pazienti scompensati che presentano segni di ritenzione idrica (stadio C e D) e si dimostra efficacissimo nell’indurre un rapido miglioramento dei sintomi (fondamentalmente la dispnea). Essi, da soli, non riescono comunque a mantenere un adeguato quadro di compenso emodinamico stabile anche perché attivano il sistema renina-angiotensina-aldosterone innestando perciò un circolo vizioso che induce la riduzione della loro efficacia nel tempo. Inoltre la contrazione del volume plasmatico da essi indotta tende a provocare riduzione del filtrato glomerulare ed “insufficienza prerenale”
Diversamente dai diuretici dell’ansa, gli antialdosteronici, che inibiscono il sistema renina-angiotensina-aldosterone, si sono dimostrati efficaci nel ridurre drasticamente la mortalità nello SC. In particolare lo Spironolattone a basse dosi (25-50 mg/die) nello studio RALES, condotto su pazienti in classe NYHA III-IV, ha ridotto del 30% la mortalità nel gruppo in trattamento attivo rispetto al placebo (6). Alalogamente l’Eplerenone ha ridotto significativamente la mortalità in pazienti scompensati con infarto miocardico acuto, come dimostrato dallo studio EPHESUS (7).
ACE-inibitori.
Grazie al loro effetto di inibizione dell’enzima di conversione dell’angiotensina I, gli ACE-inibitori limitano la produzione di angiotensina II. Di conseguenza viene bloccata l’attivazione del sistema renina-angiotensina-aldosterone e quindi vengono antagonizzate le conseguenze nefaste determinate da tale sfavorevole meccanismo fisiopatologico: vasocostrizione, ritenzione idro-salina, ipertrofia e rimodellamento del miocardio. Gli effetti clinici favorevoli che ne conseguono sono molteplici: miglioramento della sintomatologia e della tolleranza allo sforzo e, soprattutto, riduzione della mortalità e delle riospedalizzazioni. Tutto ciò è stato dimostrato sia in pazienti con SC moderato-severo, nello studio CONSENSUS (8), sia in quelli con SC lieve o asintomatico, come nello studio SOLVD prevention (9), sia nel post-infarto negli studi SAVE (10) e AIRE (11). Per tale motivo gli ACE-inibitori sono indicati per il trattamento dello SC in tutti gli stadi della malattia.
Per quanto riguarda gli inibitori dei recettori dell’angiotensina, l’altra classe di farmaci che agisce in maniera simile agli ACE-inibitori nei pazienti scompensati, essi sono indicati in alternativa a questi ultimi in caso di presenza di effetti collaterali, o in associazione ad essi nello SC refrattario nello stadio C. I benefici dell’associazione in questa tipologia di pazienti sono stati documentati dallo studio CHARM-Added (12).
Beta-bloccanti.
L’utilizzo dei beta-bloccanti, per molto tempo ritenuto controindicato nei pazienti affetti da SC sulla base del loro effetto inotropo negativo, è sostenuto da evidenze cliniche indubbie. Il razionale del loro impiego è basato sul concetto che questa sindrome è caratterizzata da una marcata iperattività adrenergica; l’utilizzo di tali sostanze induce una “upregulation” dei recettori beta adrenergici miocardici, una riduzione del lavoro cardiaco (mediato soprattutto dalla riduzione della frequenza cardiaca) ed una potenziale attività antiaritmica. Tutto ciò si è dimostrato efficace nell’indurre un miglioramento della qualità di vita ed una riduzione di mortalità (sia per SC progressivo che per morte improvvisa) nei pazienti scompensati. I farmaci di tale classe dimostratisi particolarmente efficaci sono il Metoprololo (13), il Bisoprololo (14) ed il Carvedilolo (15) che debbono essere somministrati sia a tutti i pazienti con SC sintomatico in condizioni cliniche stabili che ai pazienti con disfunzione ventricolare sinistra postinfartuale anche asintomatica. Fondamentale nell’utilizzo pratico è l’inizio della terapia con dosaggi molto bassi seguito da una progressiva, graduale, up-titration nelle settimane successive, fino a raggiungere la dose target di mantenimento che dovrebbe indurre una riduzione della frequenza cardiaca almeno a livelli inferiori a 60 battiti/min.
Inotropi non digitalici.
Nel tentativo di migliorare la performance del ventricolo insufficiente, negli ultimi anni sono stati sperimentati numerosi farmaci dotati di effetto inotropo positivo. Tra questi attualmente vengono impiegati Dopamina, Dobutamina, Milrinone e Levosimendam, il cui utilizzo viene riservato al trattamento alle fasi di SC acuto o refrattario (stadio D). Gli effetti emodinamici in acuto di queste sostanze sono molto favorevoli e caratterizzate da aumento della portata cardiaca, riduzione delle pressioni di riempimento ventricolare sinistro e vasodilatazione, ma la loro somministrazione può avvenire soltanto per brevi periodi di tempo in quanto il loro utilizzo prolungato provoca aumento della mortalità.
Terapia “elettrica”.
Le considerazioni inizialmente esposte relativamente alla insoddisfacente efficacia del trattamento farmacologico dello SC ha fatto si che negli ultimi 20 anni circa 1.000 nuovi farmaci siano stati sperimentati per la terapia dello SC cronico. Di questi soltanto nove hanno ricevuto l’autorizzazione per l’immissione in commercio. In particolare l’aggiunta di nuove classi di farmaci, come gli antagonisti delle citochine e delle endoteline, alla classica terapia basata sull’impiego di ACE-inibitori, beta-bloccanti ed antialdosteronici ha portato benefici del tutto trascurabili, ed in molti casi, è stata dannosa (Fig. 5).
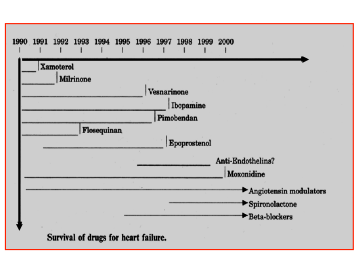
Figura 5: Sopravvivenza dei farmaci sperimentati negli ultimi 20 anni per la terapia dello SC; soltanto i modulatori del sistema renina-angiotensina-aldosterone, lo Spironolattone ed i Beta-bloccanti sono ancora in commercio.
Ma anche il trattamento con quei farmaci dimostratisi in grado di migliorare la qualità di vita e la sopravvivenza dei pazienti scompensati non è esente da limitazioni ed effetti indesiderati che ne limitano l’efficacia (Fig. 1). In particolare è noto che la terapia con ACE-inibitori e, soprattutto, beta-bloccanti non viene prescritta a tutti i pazienti che potrebbero giovarsene e, quando ciò avviene, il trattamento è per lo più sottodosato, limitando così i potenziali benefici che potrebbero derivarne. Per quanto riguarda invece gli antialdosteronici, è noto che il loro utilizzo trova limitazioni dalla eventuale presenza di insufficienza renale che espone al rischio di sviluppare iperkaliemia con conseguente possibile aumento di morbidità e mortalità (16).
Pertanto gli insufficienti risultati del trattamento farmacologico dello SC nella pratica clinica generale giustificano i molteplici tentativi di ricorrere a terapie alternative. Tra queste il trapianto cardiaco rimane il trattamento di scelta, ma la sua applicazione estensiva contrasta innanzitutto con la insufficienza di donatori ed inoltre con problematiche sia organizzative, di non facile soluzione, che di costi elevati. Di conseguenza dati europei e americani dimostrano che negli ultimi 3-5 anni si è verificata una riduzione invece che un incremento dei trapianti effettuati annualmente. E’ stato stimato che circa 40.000-50.000 pazienti presentino i criteri clinici e strumentali per poter essere inseriti in lista di attesa per il trapianto cardiaco. Di questi negli USA circa 2.500-3.000 sono effettivamente inseriti in una “lista attiva”, e soltanto un terzo viene effettivamente trapiantato; il tempo medio di attesa per l’intervento è di circa un anno (17). L’assistenza ventricolare meccanica non è applicabile in maniera estensiva. Le tecniche chirurgiche, quali la cardiomioplastica, hanno dato risultati controversi e per lo più non favorevoli.
Tutto ciò ha indirizzato l’interesse dei ricercatori verso tentativi di terapia elettrica della sindrome basata sull’impianto di sistemi di resincronizzazione cardiaca e/o defibrillatori (ICD).
Terapia di resincronizzazione cardiaca (TRC).
Il razionale alla base dell’impiego della TRC è costituito dall’evidenza che nello SC sono presenti asincronie di contrazione meccanica a più livelli (atrio-ventricolare, interventricolare ed intraventricolare sinistra) e che la presenza di tali condizioni provoca peggioramento della FE ed aumento della mortalità. Tale condizione di asinergia contrattile può essere svelata, analizzando l’ECG di superficie, da un progressivo slargamento del QRS e dall’aumento della durata dell’intervallo P-Q, fino alla comparsa di blocchi di conduzione intraventricolare o atrioventricolare. In effetti la presenza di tali asincronie in genere è associata ad anomalie di conduzione intraventricolare evidenziabili all’ECG (l’esempio paradigmatico è rappresentato dal BBsin), ma, soltanto altre tecniche di imaging (in primis l’ecocardiografia) permettono di identificarle con certezza ed, eventualmente, quantizzarle. La più frequente di queste forme di asincronia è quella intraventricolare, la cui prevalenza, nei pazienti affetti da SC, varia tra il 36% ed il 73% in presenza di QRS>120 msec, e tra il 36% ed il 51% in presenza di QRS<120 msec. La sua presenza è correlata ad un significativo aumento del rischio di mortalità totale e di morte improvvisa (18).
La prima dimostrazione degli effetti emodinamici della TRC fu data nel 1995 da Foster e coll. i quali, applicando un elettrodo ventricolare sinistro in corso di intervento cardiochirurgico di rivascolarizzazione miocardica, evidenziarono come il pacing biventricolare aumentasse significativamente la portata cardiaca e riducesse le resistenze periferiche del paziente in confronto al pacing destro o a quello ventricolare sinistro (19). Soltanto nel 1996 Cazeau e coll. riportarono i risultati di uno studio pilota sull’utilizzo della TRC, con impianto del catetere ventricolare sinistro epicardico per via toracotomia, su 14 pazienti affetti da SC in classe funzionale III-IV (20). La stimolazione biventricolare indusse un significativo miglioramento dell’indice cardiaco, della pressione di incuneamento polmonare e dell’ampiezza dell’onda V. I risultati emodinamici acuti vennero confermati al follow-up, infatti 6 pazienti su 11 rimasero stabilmente in classe funzionale NYHA II. La fattibilità dell’impianto del catetere sinistro per via transvenosa attraverso il seno coronarico, fu dimostrata da Daubert e coll. in uno studio condotto su 47 pazienti affetti da scompenso cardiaco (in classe HYHA III-IV) refrattario a terapia medica, con FE ventricolare sinistra < 35% e durata del QRS > 150 msec (21) (Fig. 6). Da questo momento in poi un notevole numero di studi clinici, osservazionali e randomizzati sono stati avviati riguardo questo argomento, che negli ultimi anni ha suscitato notevole interesse nella maggior parte dei ricercatori con competenze di elettrofisiologia e di trattamento dello SC.

Figura 6: Illustrazione di un impianto di TRC (la freccia indica il catetere stimolante in ventricolo sinistro.
Numerosi studi clinici controllati sono stati fino ad oggi condotti per verificare l’efficacia della metodica ed hanno permesso di arruolare complessivamente circa 5.000 pazienti affetti da SC. Tra i principali vanno annoverati il COMPANION (22) ed il CARE-HF (23), che hanno arruolato pazienti affetti da SC in classe NYHA III-IV e con durata del QRS>120 msec, il MADIT-CRT (24) ed il REVERSE (25) che hanno esteso l’arruolamento anche a pazienti in classe NYHA I-II. Nel loro complesso i risultati degli studi hanno chiaramente dimostrato che l’impiego della CRT, associata o meno ad ICD, mediante la correzione delle asinergie di contrazione, induce una serie di significativi risultati favorevoli documentati in caso di cardiomiopatia sia idiopatica che ad eziologia ischemica:
- riduzione della mortalità totale e della morte improvvisa (Fig. 7);
- miglioramento della classe NYHA e della qualità di vita;
- riduzione del tasso di riospedalizzazioni;
- miglioramento della funzione sistolica (ottenuto senza incrementare il lavoro cardiaco);
- riduzione dei diametri ventricolari sinistri (reverse remodelling) (26);
- riduzione dell’entità dell’insufficienza mitralica (pressoché costante nello SC moderato-severo);
- miglioramento del quadro neuro-ormonale (livelli di BNP e di Norepinefrina plasmatici).

Figura 7: Risultati dello studio CARE-HF relativamente all’end point primario ed alla mortalità totale (Ref. 23, modificata).
Tali risultati hanno fatto sì che la CRT (associata o meno ad ICD) venga consigliata da tutte le linee guida per il trattamento dello SC come presidio di classe I (livello di evidenza A) nella seguente tipologia di pazienti (27):
- presenza di SC ad eziologia sia idiopatica che ischemica;
- pazienti già in terapia medica massimale tollerata;
- FE≤35%;
- classe NYHA III-IV (durata del QRS>120 msec);
- classe NYHA II (durata del QRS≥150 msec).
Pertanto la TRC, nonostante alcune problematiche ancora non risolte (in primis quelle legate al costo dei devices ed all’elevata percentuale di non responder al pacing), è oggi un presidio fondamentale per il trattamento dei pazienti scompensati. In particolare la TRC presenta anche dei vantaggi teorici rispetto alla terapia medica:
- ha come bersaglio soltanto il cuore e quindi non coinvolge, come avviene per la terapia farmacologia, processi biologici ubiquitari in maniera spesso difficilmente prevedibile;
- i suoi effetti sono agevolmente e rapidamente obiettivabili;
- non ha sfavorevoli effetti sul metabolismo miocardico;
- non ha limitazioni legate all’età dei pazienti o a disfunzioni di altri organi o apparati;
- ha una compliance del 100%.
Defibrillatore impiantabile (ICD).
Come precedentemente evidenziato, oltre il 40% dei pazienti affetti da SC muoiono a causa di morte improvvisa aritmica. In maniera caratteristica la modalità del decesso sembra variare in rapporto alla classe funzionale NYHA di appartenenza, in effetti nelle classi più basse, come la II, la morte è prevalentemente di tipo improvviso nel 50-80% dei casi, mentre nelle classi più avanzate, come la IV, è legata a SC progressivo nel 70-95% dei casi (Fig. 8).

Figura 8: Modalità di decesso nello SC in relazione alla classe funzionale NYHA (Da MERIT-HF Study Group. Ref. 28, modificata).
Gli studi clinici sull’effetto dei farmaci antiaritmici sono risultati deludenti al fine della prevenzione della morte improvvisa nello scenario della disfunzione ventricolare sinistra. Tale considerazione è comunque confinata ai farmaci antiaritmici di classe I (studi CAST e CASH) e di classe III puri (studi SWORD e DIAMOND-CHF), che si sono dimostrati inefficaci nella prevenzione dell’insorgenza delle aritmie ventricolari ed in alcuni casi addirittura associati ad un maggior rischio di morte improvvisa o ad un aumento generico della mortalità.
Discorso a parte va fatto per i farmaci di classe II (beta-bloccanti) e l’amiodarone. I primi, oltre ad avere un effetto benefico sulla sintomatologia, si sono dimostrati in grado di ridurre la mortalità totale, quella improvvisa e quella per SC progressivo, nei pazienti con SC sintomatico associato a disfunzione ventricolare sinistra, sia di eziologia ischemica che non. Il trattamento con Carvedilolo nello U.S. Carvedilol Heart Failure Study (15) ha ridotto del 65% la mortalità totale, portando la mortalità per SC dal 3.3% del gruppo placebo al 0.7 % di quello in trattamento e quella per morte improvvisa dal 3.8% al 1.7%. Il Metoprololo nello studio MERIT-HF (13) è stato in grado di ridurre del 34% la mortalità totale, con una diminuzione delle morti per progressione dello scompenso del 49% e di quelle per morte improvvisa del 41%. Risultati simili sono stati ottenuti con l’utilizzo del Bisoprololo. Numerosi sono stati gli studi clinici condotti sull’utilizzo dell’Amiodarone, uno dei farmaci antiaritmici più utilizzato nel trattamento e nella prevenzione delle aritmie ventricolari, associate o non a SC. Il suo utilizzo in questa condizione patologica è legato essenzialmente al suo scarso potere inotropo negativo e alla sua supposta efficacia nel sopprimere le aritmie ventricolari. Tuttavia, l’evidenza scientifica che supporta questa affermazione è tutt’altro che fondata (29). La maggioranza delle informazioni sull’efficacia clinica dell’Amiodarone nel trattamento delle aritmie ventricolari sono osservazionali. Inoltre, non esistono studi randomizzati controllati con placebo sulla sua efficacia nella prevenzione delle aritmie ventricolari sostenute. Alcuni studi controllati con placebo sull’utilizzo profilattico dell’amiodarone nei pazienti con SC o pregresso infarto miocardico senza storia di aritmie ventricolari sostenute, hanno dimostrato una modesta e non costante riduzione della morte su base aritmica (studi CAMIAT, EMIAT, STAT-CHF, GESICA). Inoltre non è stato dimostrato alcun effetto positivo sulla mortalità totale (29).
Viste l’elevata frequenza di aritmie ventricolari e morte improvvisa nei pazienti con SC, e l’elevata efficacia nel riconoscimento e nel trattamento delle aritmie ventricolari da parte dell’ICD, numerosi studi randomizzati hanno tentato di analizzare l’impatto della terapia con ICD sulla sopravvivenza dei pazienti ad alto rischio di morte improvvisa. L’utilizzo dell’ICD in prevenzione secondaria in pazienti sopravvissuti ad aritmie maggiori è ormai un dato acquisito dalla comunità scientifica ed è divenuto uno standard terapeutico nella pratica clinica quotidiana. Negli ultimi anni tuttavia numerose evidenze si sono accumulate per quanto riguarda l’utilizzo di ICD anche in prevenzione primaria in pazienti ad elevato rischio per morte improvvisa. Fondamentali a tale riguardo sono stati i risultati ottenuti nei trial MADIT II (30) e SCD-HeFT (31). Il primo studio ha efficacemente dimostrato come pazienti con pregresso IMA e bassa FE beneficiassero dell’impianto di ICD con una riduzione della mortalità totale del 31% indipendentemente dall’inducibilità di aritmie maggiori (30). Pertanto l’impianto di ICD non doveva essere basato sui risultati di uno studio elettrofisiologico, ma soltanto sul riscontro di una bassa FE. Lo studio SCD-HeFT ha confrontato l’efficacia della terapia con Amiodarone nei confronti dell’impianto di ICD in pazienti con SC, FE<35% e classe NYHA II-III, avendo come end point principale quello della mortalità totale. I risultati sono stati a favore dell’ICD, in quanto i pazienti trattati con il device hanno ottenuto una significativa riduzione della mortalità (- 23%) rispetto a quelli trattati con l’antiaritmico (31).
Pertanto l’impianto di ICD nei pazienti affetti da SC viene oggi raccomandato dalle linee guida in Classe I, per soggetti per i quali sia prevedibile un’aspettativa di vita di almeno un anno, in:
- Prevenzione secondaria: nei pazienti con FE≤40%
- Prevenzione primaria: nei pazienti con FE≤35% e classe NYHA II-III (se etiologia ischemica l’impianto deve avvenire almeno 40 giorni dopo l’infarto acuto) (32).
Conclusioni.
Lo SC è una sindrome il cui trend di prevalenza, specie negli anziani, è in continuo aumento. Nonostante i progressi della terapia farmacologica, la mortalità ed il tasso di riospedalizzazione dei pazienti affetti da tale patologia rimangono molto elevati, come documentato da studi di popolazione (3). Gli studi clinici controllati condotti negli ultimi anni impiegando sia farmaci che devices hanno dato però risultati estremamente incoraggianti (Fig. 9).
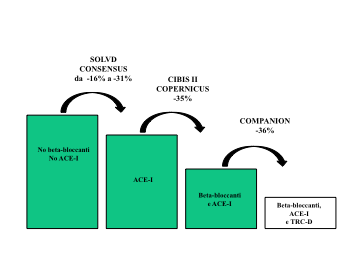
Figura 9: Riduzione della mortalità e delle riospedalizzazioni da parte della terapia di resincronizzazione cardiaca associata all’ICD (TRC-D) nello studio COMPANION confrontata con quella degli studi con ACE-I e beta-bloccanti.
Rimane da colmare il gap esistente tra pratica clinica quotidiana e ricerca clinica che ancora oggi vede sottoutilizzati sia farmaci fondamentali per la cura del paziente scompensato che l’impiego dei nuovi trattamenti “elettrici”. A tale riguardo, lo studio IMPROVE-HF, condotto nel 2008 su pazienti ambulatoriali statunitensi affetti da SC, allo scopo di verificare l’effettivo impiego delle risorse terapeutiche, ha dato risultati deludenti (33). Gli ACE-I/ARBs, ad esempio, erano impiegati soltanto nel 78% dei pazienti, i beta-bloccanti nel 85% e la TRC, associata o meno ad ICD, nel 37% (33) (Fig. 10).


Figura 10: Utilizzo di ACE-I/ARBs (alto) e TRC/ICD (basso) nei pazienti affetti da SC. Ogni segmento verticale indica il singolo ambulatorio che ha partecipato allo studio e la relativa percentuale di pazienti a cui è stato prescritto il farmaco/device. La linea orizzontale indica la mediana relativa a tutti i partecipanti (Ref. 33, modificata).
BIBLIOGRAFIA
- Cleland JG, Cohen-Solan A, Aguilar JC. Management of heart failure in primary care (the IMPROVEMENT of heart failure program): an international survey. Lancet 2002;360:1631.
- Lewy D, Kenchaian S, Larson M, et al. Long-term trends in the incidence and survival with heart failure. N Engl J Med 2002;347:1397.
- MacIntyre K, Capwell S, Stewart S, et al. Evidence of improving prognosis in heart failure. Circulation 2000;102:1126.
- Hunt SA, Abraham WT, Chin MH, et al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation. JACC 2009;53:e1.
- The Digitalis Investigation Group. The effect of digoxin on mortality and morbidity in patients with heart failure. NEJM 1997;336:525.
- Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. NEJM 1999;341:709.
- Pitt B, Remme W, Zannad F, et al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. NEJM 2003;348:1309.
- The CONSENSUS Trial Study Group. Effects of Enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). NEJM 1987;316:1429.
- The SOLVD investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fraction. NEJM 1992;327:685
- Pfeffer MA, Braunwald E, Moye IA, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the Survival and Ventricular Enlargement Trial. NEJM 1992;327:669.
- Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Lancet 1993;342:821.
- McMurray JJ, Ostergren J, Swedberg K, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. 2003;362:767.
- MERIT-HF Study Group. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL randomized intervention trial in congestive heart failure (MERIT-HF). Lancet 1999;353:2001.
- CIBIS Investigators and Committees. A randomized trial of beta blockade in heart failure: the Cardiac Insufficiency Bisoprololo Study (CIBIS). Circulation 1994;90:1765.
- Packer M, Bristow MR, Cohn JN, et al. The effect of Carvedilol on morbidity and mortality in patients with chronic heart failure. NEJM 1996;334:1349.
- Juurlink DN, Mamdani MM, Lee DS, et al. Rates of hyperkalemia after publication of randomized aldactone evaluation study. NEJM 2004;351:543.
- Kauffman HM, McBride MA, Schield CF, et al. Determinants of waiting time for heart transplants in the United States. J Heart Lung Transplant 1999;18:414.
- Baldasseroni S, Opasich C, Gorini M, e al. Left bundle-branch block is associated with increased 1-year sudden and total mortality rate in 5517 outpatients with congestive heart failure: A report from the Italian Network on Congestive Heart Failure. Am Heart J 2002;143:398.
- Foster AH, Gold MR, McLaughlin JS. Acute hemodynamic effects of atrio-BVP in humans. Ann Thorac Surg 1995;59:294.
- Cazeau S, Ritter P, Lazarus A, el al. Multisite pacing for end-stage heart failure: early experience. PACE 1996;19:1748.
- Daubert JC, Ritter P, Le Breton H, et al. Permanent left ventricular pacing with transvenous lead inserted into the coronary veins. PACE 1998;21:239.
- Bristow MR, Saxon LA, Boehmer J, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. NEJM 2004;350:2140.
- Cleland JGF, Daubert J-C, Erdman E, et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. NEJM 2005;352:1539.
- Moss AJ, Hall WJ, Cannom DS, et al. Cardiac-resynchronization therapy for the prevention of heart-failure events. NEJM 2009;361:1329.
- Daubert C, Gold MR, Abraham WT, et al. Prevention of Disease Progression by Cardiac Resynchronization Therapy in Patients With Asymptomatic or Mildly Symptomatic Left Ventricular Dysfunction Insights From the European Cohort of the REVERSE (Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction) Trial. JACC 2009;54:1837.
- St John Sutton, keane MG. Reverse remodelling in heart failure with cardiac resynchronization therapy. Heart 200/,93:167.
- 2010 Focused Update of ESC guidelines on device therapy in heart failure. Eur Heart J 2010;31:2677.
- MERIT Investigators. Effect of Metoprolol CR/XL in chronic heart failure: metoprolol CR/XL randomised intervention trial in congestive heart failure (Merit-HF). Lancet1999;353:2001.
- Connolly SJ. Evidence-based analysis of amiodarone efficacy and safety. Circulation 1999;100:2025.
- Moss AJ, Zareba W, Hall WJ, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. NEJM 2002;346:877.
- Bardy GH, Lee KL, Mark DB, et al. Amiodarone or implantable cardioverter-defibrillator for congestive heart failure. NEJM 2005;352:225.
- ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. Eur Heart J 2008;29:2388.
- Fonarow GC, Yancy CW, Albert NM, et al. Heart failure care in the outpatient cardiology
practice setting. Findings from IMPROVE HF. Circ Heart Fail 2008;1:98.











.png)





