Il trattamento delle dislipidemie: luci, ombre e prospettive
Enrico Bologna
Specialista in Medicina Interna, Gastroenterologia e Patologia generale.
Già Primario Ospedale Fatebenefratelli, Isola Tiberina, Roma.
Libero docente in Patologia Medica, Università di Roma “Sapienza”.
Nonostante la crescente disponibilità di farmaci efficaci nel trattamento dell’ipertensione arteriosa, del diabete mellito tipo 2 e delle dislipidemie, i progressi ottenuti negli ultimi quattro decenni nella prevenzione primaria e secondaria delle malattie cardiovascolari si stanno perdendo, in concomitanza con la crescente diffusione della sindrome metabolica nelle sue varie espressioni.
Particolarmente preoccupante, in questo senso, è il rilievo di un rallentamento nel declino della letalità cardiovascolare segnalata negli USA a partire dagli anni ’90 e confermata da uno studio condotto nel Regno Unito sull’andamento della letalità coronarica tra il 1984 e il 2004. Si è visto che la tendenza alla costante diminuzione della letalità ha cominciato a ridursi a partire dalla metà degli anni ’90,Tale riduzione, che riguarda i soggetti di entrambi i sessi, si osserva solo nelle fasce di età 35-44 e 45-54 anni e non nei soggetti più anziani (49). Questa particolarità fa attribuire il fenomeno alla diffusione della sindrome metabolica che ha avuto luogo negli ultimi anni, che si manifesta fin dalla giovane età e che è particolarmente grave in Gran Bretagna.
La strategia per la prevenzione delle malattie cardiovascolari si fonda su interventi multifattoriali volti a raggiungere determinati valori lipemici, di pressione arteriosa e di controllo glicemico. Nei soggetti diabetici, in particolare, uno studio condotto su 160 soggetti seguiti in media per 5,4 anni ha dimostrato che il trattamento farmacologico che più efficacemente ha contribuito a migliorare la prognosi è stato quello con statine, seguito nell’ordine da quelli con antiipertensivi, con ipoglicemizzanti e con antiaggreganti (19).
Nei diabetici, comunque, tutti questi trattamenti sono in grado di prevenire la microvasculopatia solo in circa la metà dei casi, come dimostrato dallo Studio STENO-2 (18,19). Anche quando il trattamento consente di raggiungere i valori desiderati di LDL-C il rischio cardiovascolare rimane elevato. Una metanalisi condotta su 14 studi clinici controllati, relativa ad un totale di oltre 90.000 soggetti di cui il 20% diabetici, ha dimostrato che il 14% dei pazienti va incontro, nonostante il trattamento con una statina, a infarto del miocardio entro 5 anni ( 4,35). Inoltre, come ha dimostrato lo Studio TNT, il rischio rimane elevato anche quando la dose di statina viene portata al massimo (12,41).
Questi rilievi indicano la necessità di considerare con maggiore attenzione le modalità di prevenzione nei confronti della dislipidemia aterogena, quella che si osserva tipicamente in concomitanza di anomalie metaboliche e che, secondo lo Studio INTERHEART, condotto su oltre 15.000 soggetti arruolati in 62 paesi dei cinque continenti, è responsabile di oltre il 50% del rischio globale di infarto del miocardio (61), precedendo per importanza ipertensione arteriosa, diabete mellito, obesità addominale, etc.
La dislipidemia che più spesso si osserva nei soggetti con diabete mellito o con sindrome metabolica e che ne condiziona il rischio aterogeno non è costituita esclusivamente da elevati valori di LDL-C, ma nella maggior parte dei casi anche o prevalentemente da bassi valori di HDL-C e da aumento dei trigliceridi e spesso di Apolipoproteina B (Apo B) e di non HDL-C.
Un recente studio condotto in pazienti coronaropatici ha dimostrato mediante ecografia intravascolare che l’entità della stenosi coronarica progredisce se il rapporto LDL-C/HDL-C è superiore a 1,5 mentre regredisce quando questo rapporto è inferiore a questo limite ( 47). In base a questi rilievi è stato calcolato che in un paziente coronaropatico con HDL-C pari a 50 mg/dL il valore di LDL-C non dovrebbe superare i 75 mg/dL, e che se HDL-C è 30 mg/dL il valore di LDL-C non dovrebbe superare i 45 mg/dL, cià che appare in accordo con quanto previsto dalle attuali linee guida.
Per quanto riguarda i trigliceridi, in uno studio condotto su 26.509 donne partecipanti al Women’s Health Study seguite per una mediana di oltre 11 anni, il valore dei trigliceridi misurati 2 – 4 ore dopo il pasto ha mostrato una stretta correlazione con gli eventi cardiovascolari, correlazione che non si è osservata per i valori ottenuti a digiuno (5). In particolare, il rischio di ictus ischemico aumenta con l’aumentare dei valori postprandiali: rispetto ai soggetti con valori inferiori a 90 mg/dL il rischio aumenta progressivamente fino al 250% per valori superiori a 440 mg/dL (16).
Un altro parametro da considerare è Apo B, che nei soggetti con diabete mellito o con sindrome metabolica è più spesso aumentata rispetto a LDL-C. L’interesse per questa lipoproteina dipende dal fatto che la sua concentrazione plasmatica rappresenta la somma di quella delle particelle aterogene e cioè VLDL, IDL, remnants, LDL e apolipoproteina (a), in quanto tutte contengono una ,molecola di Apo B.
Un recente Consensus Statement della American Diabetes Association/American College of Cardiology (ADA/ACC) indica nella concentrazione di Apo B un miglior predittore di coronaropatia rispetto a LDL-C, in quanto quest’ultimo rappresenta solo una parte della potenzialità aterogena delle particelle lipidiche circolanti (10).
Una conferma del valore prognostico dei valori di Apo B viene inoltre dalle osservazioni condotte nel Framingham Heart Study su circa 3.000 pazienti con sindrome metabolica. In questi soggetti fu rilevata una stretta correlazione fra concentrazione di Apo B, numero di particelle LDL (determinato mediante RMN) e numero di criteri presenti per sindrome metabolica, correlazione del tutto assente con i valori di LDL-C (14). L’importanza di questo rilievo risiede nel fatto che la misurazione delle particelle LDL mediante RMN fornisce, a differenza dalla misurazione chimica, una fedele valutazione del numero, e quindi delle dimensioni, delle particelle stesse
Le osservazioni sopra riportate indicano che la dislipidemia più frequente e più spesso associata con le malattie cardiovascolari e in particolare con le coronaropatie è l’iperlipemia mista familiare (37) in cui elevati valori di LDL-C sono accompagnati da aumento dei trigliceridi e delle particelle LDL piccole e dense e da riduzione di HDL-C. La coesistenza di queste alterazioni dipende dal fatto che il trasporto delle ipoproteine è un sistema integrato a riciclo(Fig. 1); ciò indica anche che tutte le varie tappe di questo sistema possono costituire dei possibili bersagli della terapia farmacologica.
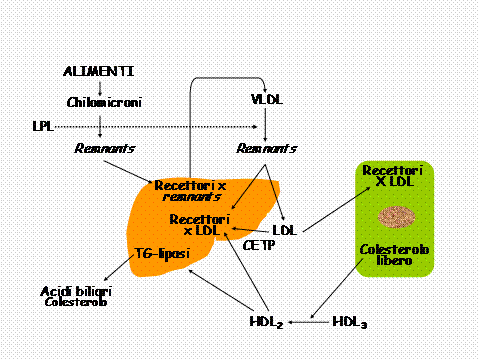
Fig. 1 (modif. da 37)
Sotto questo punto di vista gli attuali standard di trattamento della dislipidemia, basati sulla correzione delle abitudini di vita e sull’uso delle statine, possono rivelarsi non del tutto adeguati per una efficace prevenzione dell’aterogenesi. Perciò viene da più parti segnalata la necessità sia di agire più efficacemente sui comportamenti alimentari e sull’attività fisica, sia di rivedere la scelta e le modalità di impiego dei farmaci attualmente disponibili come anche di valutare le possibilità offerte dalle associazioni e dai farmaci di prossima immissione in commercio (Fig. 2). Sono questi gli aspetti del trattamento farmacologico delle dislipidemie che verranno qui presi in considerazione.
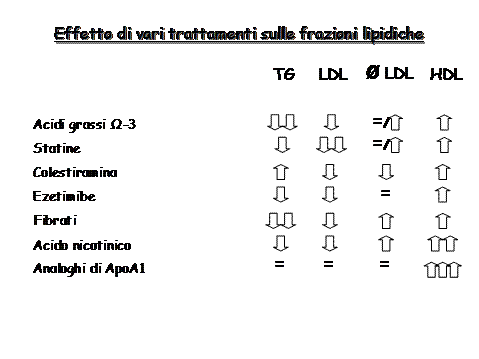
Fig. 2
Acidi grassi ω-3
Statine
Tulle le statine disponibili (Lovastatina, Simvastatina, Pravastatina, Fluvastatina, Atorvastatina e Rosuvastatina) sono inibitori competitivi di HMG CoA reduttasi, che controlla la produzione di Mevalonato, tappa fondamentale nella biosintesi del colesterolo. La riduzione del colesterolo intraepatico che consegue a questa inibizione stimola l’attività dei recettori LDL epatici. Attraverso l’inibizione di HMG CoA reduttasi le statine ostacolano anche la sintesi di molti altri composti, fra cui i derivati geranilati e farnesilati; a questa azione si devono i cosiddetti effetti pleiotropici, fra cui dominano per importanza quelli che proteggono i vasi in modo indipendente dall’azione ipocolesterolemizzante.
Le statine sono i farmaci che più nettamente riducono LDL-C (30-60%), mentre più modesta è la capacità di incrementare HDL-C; le molecole che appaiono più potenti per entrambi gli effetti sono Rosuvastatina e Atorvastatina.
Benché raramente, le statine possono determinare effetti avversi a carico del fegato e dei muscoli. Nello 0,5 – 3,0% dei pazienti si osservano aumenti persistenti delle transaminasi, che in genere compaiono nei primi tre mesi di trattamento, sono dose-dipendenti e scompaiono con la sospensione della statina. L’incidenza di questo fenomeno è peraltro prossima a quella osservata per il placebo. Se il valore delle transaminasi supera in modo persistente il triplo del valore massimo normale è comunque opportuno sostituire la statina o ridurne la dose.
Per quanto riguarda il danno muscolare, questo comprende una seriedi manifestazioni
che vanno dalle mialgie alle miositi fino alla rabdomiolisi, che può associarsi a insufficienza renale acuta. Si tratta di un rischio raro nei casi di trattamento con la sola statina (2-11% per le mialgie, 0,5% per le miositi, 0,1% per la rabdomiolisi), che di solito si presenta nei primi mesi di trattamento e scompare entro poche settimane dalla sospensione. E’ meno frequente con Pravastatina e Fluvastatina mentre prevale nel caso di condizioni predisponenti quali insufficienza renale acuta o cronica, epatopatia ostruttiva e ipotiroidismo, ma soprattutto per effetto di interazioni ad opera di farmaci che inibiscono l’isoenzima CYP3A4 da cui dipende la biotrasformazione di Lovastatina, Simvastatina e in misura minore Atorvastatina, mentre le altre statine seguono vie metaboliche diverse (54). Ricordiamo tra questi farmaci Claritromicina, gli antiretrovirali, gli antimicotici azolici, Isoniazide, Amiodarone, Ciclosporina, Diltiazem, Verapamil; analogo effetto può avere il succo di pompelmo quando ne vengano ingeriti akmeno 500 mL. Interazioni sono possibili anche con i fibrati, che come già ricordato competono con le statine per l’eliminazione ad opera della glicuronidasi; si tratta peraltro di un rischio molto modesto con Fenofibrato rispetto a Gemfibrozil. Esiste inoltre una possibile interazione fra anticoagulanti orali e statine: Acenocumarolo ostacola la biotrasformazione di Atorvastatina, Lovastatina e Simvastatina, mentre Warfarina ostacola quella di Fluvastatina e, in modesta misura, di Rosuvastatiìna.
Vi sono anche rare segnalazioni di proteinuria e di insufficienza renale in corso di trattamento con statine, soprattutto Rosuvastatina e Simvastatina; inoltre di disturbi della memoria che in alcuni casi sono regrediti con la sospensione del trattamento (60).
Non confermati, infine, i sospetti sulla possibilità che l’uso di statine possa favorire la comparsa di neuropatie, di cataratta o di neoplasie (2).
Un rischio poco noto connesso con l’uso delle statine è quello legato alla brusca sospensione del trattamento. Nell’animale questo determina aumento delle lesioni aterosclerotiche sperimentali mentre, nell’uomo provoca rilevante aumento dei marker di infiammazione e di attivazione piastrinica (21,53)
La conferma clinica dell’importanza di questo fenomeno è venuta da un recente studio controllato su 215 pazienti, nei quali l’improvvisa sospensione del trattamento dopo un ictus ischemico si è associata a un significativo aumento di letalità, di accrescimento dell’area infartuata e di deterioramento neurologico rispetto ai controlli (7)
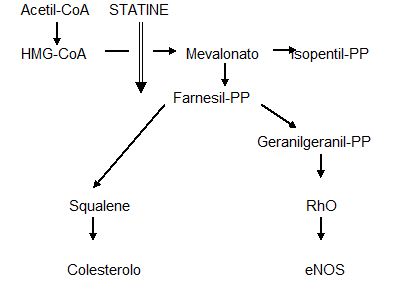
La spiegazione di questo effetto avverso va ricercata nell’effetto che il blocco di HMG-CoA reduttasi e quindi della produzione di Mevalonato determina sulla sintesi dei derivati isoprenoidi e in particolare della proteina RhoA, che regola negativamente l’espressione della sintetasi endoteliale di NO (eNOS). Durante il trattamento con statine vi è sopraregolazione del gene di Rho con accumulo citoplasmatico di Rho non isoprenilato. Al momento della sospensione della statina il brusco aumento di RhoA attivo sopprime l’attività di eNOS con aumentato rischio di eventi ischemici (Fig. 3).
E’ verosimile che il rischio da interruzione del trattamento con statine sia inversamente proporzionale all’emivita plasmatica delle singole statine: questa è di 20-30 ore per Atorvastatina (considerandone anche i metaboliti attivi), 21 per Rosuvastatina, 2,5 per Fluvastatina (9 ore per la forma farmaceutica a lenta cessione), 2 ore per Simvastatina e 1,5 ore per Lovastatina.
Fibrati
Grazie all’effetto agonista nei confronti dei PPAR, i fibrati riducono del 20-30% la concentrazione plasmatica dei trigliceridi; la riduzione è anche maggiore in caso di valori molto elevati soprattutto postprandiali, che come si è detto sono quelli che meglio si correlano con il rischio vascolare. I fibrati provocano inoltre aumento del 5-10% dei valori di HDL-C stimolando l’espressione di ApoA-I e ApoA-II, riducono LDL-C e ApoCIII ed esercitano azione antiinfiammatoria proteggendo l’endotelio arterioso (26,59).
La capacità dei fibrati di ridurre morbilità e letalità cardiovascolare è discussa; nello Studio FIELD condotto su 10.000 pazienti l’analisi dei risultati è disturbata dal contemporaneo uso di statine in molti soggetti. (36).
Associati a una statina i fibrati potenziano la riduzione di TG, ApoB, non HDL-C e VLDL-C e l’aumento di HDL-C, ma fanno temere il rischio di miopatia che entrambe le classi di farmaci possono comportare. In realtà il rischio riguarda soprattutto Gemfibrozil, che molto più di Fenofibrato compete con le statine per l’eliminazione ad opera della glicuronidasi, e che fu responsabile di gran parte dei casi di grave interazione con Cerivastatina.
Nessun caso di miopatia, infatti, è stato segnalato negli 890 pazienti che hanno aggiunto una statina al fenofibrato nello studio FIELD (1,20,33,36,51).
Lo studio ACCORD (Action to Control Cardiovascular Risk in Diabetes), riguardante oltre 10.000 pazienti seguiti per 5,6 anni, porterà entro il 2009 nuove informazioni sugli effetti della associazione Simvastatina + Fenofibrato (23).
In uno studio di fase 3 la somministrazione per 3 mesi di un nuovo fibrato (ABT-335) e/o Rosuvastatina a 1.445 pazienti con dislipidemia mista ha corretto i parametri lipidici molto più efficacemente della monoterapia con ciascuno dei due farmaci senza indurre effetti avversi muscolari, epatici o renali (33).
Colestiramina
Unica resina a scambio ionico disponibile in Italia, lega gli acidi biliari nell’intestino e ne ostacola il riassorbimento. Ne consegue riduzione del colesterolo intraepatico che stimola la sintesi di recettori per LDL il cui aumento determina ulteriore riduzione del colesterolo plasmatico.. Il trattamento con Colestiramina trova un limite nella frequente intolleranza digestiva che la resina determina e nella capacità di sequestrare e quindi ridurre la biodisponibilità di numerosi farmaci (inclusi Warfarina, fibrati e statine) e vitamine.
Ezetimibe
Ezetimibe ostacola l’assorbimento del colesterolo biliare e alimentare da parte degli enterociti e riduce di circa il 17% la concentrazione plasmatica di LDL-C; associato a Simvastatatina riduce LDL-C di un ulteriore 14%.
Nello Studio ENHANCE, condotto su 720 soggetti con ipercolesterolemia familiare trattati con Simvastatina 80 mg da sola o associata a Ezetimibe, è stata rilevata riduzione dei valori di LDL-C del 39 e del 56%, associata ad aumento di HDL-C dell’8 e del 10%.
Nonostante questo effetto i risultati a due anni (eventi cardiovascolari e spessore intima-media delle carotidi) non hanno mostrato significative differenze. Una riduzione significativa di eventi ischemici coronarici, invece è stata osservata in soggetti con stenosi aortica (55), ma in questa ricerca fu rilevata una maggior frequenza di neoplasie nei soggetti trattati rispetto ai controlli; una successiva analisi dei dati di tre ricerche condotte con l’impiego di ezetimibe non ha confermato questo rapporto (51).
Acido nicotinico
L’acido nicotinico (Niacina degli autori anglosassoni), un tempo utilizzato in modo piuttosto empirico come “vasodilatatore”, dimostrò la sua capacità di modificare favorevolmente il quadro lipidico e la prognosi dei soggetti cardiovasculopatici nel primo grande studio clinico controllato in doppio cieco contro placebo effettuato in USA oltre 30 anni fa, il Coronary Drug Project. In questo studio, condotto in 1.119 uomini infartuati con trigliceridemia a digiuno superiore a 300 mg/dL furono utilizzati anche Clofibrato, estrogeni e D-tirossina. I trattamenti con questi ultimi due farmaci, dimostratisi dannosi, furono interrotti, mentre Clofibrato risultò inefficace. L’Acido nicotinico, alla dose di 3 g/die, ridusse gli eventi coronarici del 27% e comportò la riduzione dei trigliceridi del 19,4% e del colesterolo totale del 9,6%. Nel gruppo così trattato un controllo a 15 anni rivelò una significativa riduzione della letalità anche nei soggetti diabetici, mentre non vennero riportati effetti avversi di rilievo, tranne una più elevata frequenza di fibrillazione atriale (4,7% vs 2,9% nel gruppo placebo) (11).
Acido nicotinico, come componente dei coenzimi NAD (Nicotinamide Adenine Dinucleotide) e NADP (Nicotinamide Adenine Dinucleotide Phosphate) interviene in molte reazioni di ossido-riduzione comprese quelle relative al metabolismo lipidico e glicidico via ciclo di Krebs. In particolare, inibendo l’attività dell’enzima CETP (Cholesteryl Esters Transfert Protein) determina aumento di HDL e riduce la produzione di VLDL e di LDL, mentre rallenta la degradazione di ApoA-1. Sono inoltre dimostrati effetti favorevoli sulla funzione endoteliale ed attività antiinfiammatoria, antitrombotica e stabilizzante la placca (31,45).
Il più comune effetto avverso è costituito dall’arrossamento cutaneo con prurito e spesso cefalea, che rappresenta il principale motivo di inosservanza del trattamento. Questo fenomeno è causato dallo stimolo alla produzione di Prostaglandina D2 (PD2) che provoca vasodilatazione agendo sui recettori DP1. L’inconveniente può essere limitato utilizzando preparati a cessione protratta, che evitano picchi di concentrazione plasmatica, ovvero con la contemporanea somministrazione di un antiprostaglandinico (di solito viene impiegato Ac. acetilsalicilico (325 mg ogni 12 ore) (9,40,42)
Altro effetto avverso di Acido nicotinico è l’aumento della insulinoresistenza e, in pazienti con sindrome metabolica e ridotta tolleranza glicidica, l’insorgenza di diabete mellito. Più raro l’aumento delle transaminasi e l’iperuricemia con crisi gottose.(22,27,29),
Per combattere la vasodilatazione è stato proposto, in sostituzione di Acido acetilsalicilico, un antagonista dei recettori DP1 recentemente sintetizzato, il Laropiprant. (9,40,42). La recente dimostrazione dell’efficacia della associazione Acido nicotinico-statine (44) ha sollevato notevole interesse; vi è quindi attesa per la conclusione di due studi clinici randomizzati e controllati: il primo, che si concluderà nel 2011, Atherothrombosis Intervention in Metabolic Syndrome with Low HDL/High Triglycerides and Impact on Global Health outcomes (AIM-HIGH) confronta l’efficacia di Simvastatina da sola con l’associazione di Simvastatina con Acido nicotinico a cessione protratta in circa 3.000 pazienti vasculopatici con dislipidemia aterogena. Il secondo (Heart Protection Study 2 – treatment of HDL to reduce the Incidence of Vascular Events, HPS2-THRIVE, che terminerà nel 2012, mette a confronto il trattamento con Acido nicotinico a cessione protratta associato a Laropiprant contro placebo in circa 20.000 pazienti con arteriopatia periferica o pregresso IMA o ictus nei quali la concentrazione plasmatica di LDL-C è stata portata a valori ottimali mediante una statina (17).
Nell’aprile 2008
Nel luglio 2008 la associazione, con il nome Tredaptive®, è stata approvata dalla EMEA e sarà quindi presto disponibile in Europa.
Farmaci ipoglicemizzanti
Sia i PPARγ-agonisti (tiazolidinedioni) sia Metformina agiscono non solo sul metabolismo glicidico, ma anche su quello lipidico e lipoproteico.
I tiazolidinedioni Pioglitazone e Rosiglitazone hanno effetti simili sulla sensibilità all’insulina e sull’infiammazione, ma differenti sui lipidi. Infatti Pioglitazone riduce i trigliceridi del 15-20%, aumenta HDL-C del 10-13% e non modifica o fa aumentare del 5% LDL-C, mentre Rosiglitazone può provocare aumento dei trigliceridi del 10-20%, di HDL-C del 5-7% e di LDL-C del 5-20% (25). Benché il trattamento con Pioglitazone sia stato associato con una riduzione di eventi cardiovascolari in pazienti diabetici ad alto rischio, i reali vantaggi del trattamento con tiazolidinedioni potranno essere chiariti solo da studi prospettivi (17).
Il trattamento con Metformina provoca riduzione di LDL-C e dei trigliceridi (circa 10 mg/dL per entrambi), mentre non determina variazioni significative di HDL-C (8).
Nuove prospettive
Gli effetti favorevoli sull’assetto lipidico svolti da alcuni agonisti PPAR hanno stimolato numerose ricerche su agonisti PPAR multipli. La sperimentazione di vari agonisti PPARα/γ è stata interrotta per il rilievo nei soggetti trattati di insufficienza cardiaca, disfunzione renale o rabdomiolisi. Per questi motivi,
Anche per questo motivo la ricerca è attualmente rivolta prevalentemente verso lo sviluppo di modulatori dei PPAR con attività selettiva.
Considerato l’effetto antiaterogeno di HDL-C, è stato compiuto il tentativo di inibire la proteina di trasporto CETP (Cholesteryl Ester Tranfer Protein), ghe promuove il trasferimento di colesterolo nel plasma dalla frazione HDL a quella proaterogena LDL, come anche il trasporto di trigliceridi da LDL ad HDL. Il primo inibitore pervenuto alla sperimentazione clinica, Torcetrapib, è stato somministrato in associazione con Atorvastatina a confronto con la sola Atorvastatina. La sperimentazione fu interrotta per il rilievo di un significativo eccesso di letalità nei pazienti trattati con l’associazione, che peraltro aveva determinato un aumento di HDL-C di ben il 72%. Non è stato possibile stabilire se questo fenomeno sia da riferire alla produzione di HDL aterogene in conseguenza dell’inibizione di CETP o da un effetto sfavorevole sul sistema RAA (6).
Ricerche sono in corso con altri inibitori di CETP.
Un’altra modalità per ottenere l’aumento di HDL-C è quella di provocalo direttamente somministrando questa proteina come tale ovvero sotto forma del suo principale componente Apo A-1 o di analoghi che ne condividano le caratteristiche fisico-chimiche cui si deve l’azione antiaterogena di HDL: queste sono rappresentate da una struttura amfipatica in cui il versante polare permette la solubilità nel plasma e quella non polare il legame lipidico.
In conigli resi aterosclerotici mediante alimentazione iperlipidica quattro infusioni endovenose settimanali di HDL ricostituita hanno permesso di ottenere una significativa riduzione dell’aterosclerosi aortica (3). Uno studio analogo è stato più recentemente compiuto nell’uomo utilizzando apo A-1 Milano (una forma di HDL derivata da mutazione del gene che si associa a basso rischio di aterosclerosi). Apo A-1 ricombinante è stata somministrata, in uno studio controllato, a pazienti con sindrome coronarica acuta, nei quali prima e dopo il trattamento è stato valutato, mediante ecografia intracoronarica, il volume degli ateromi. Il risultato, in analogia con quello sperimentale, è stato di una significativa riduzione volumetrica delle lesioni (43).
La difficoltà di ottenere Apo A-1 Milano ricombinante ha indotto a sviluppare analoghi che ne condividono le caratteristiche fisico-chimiche e che hanno dimostrato di possedere gli effetti antiinfiammatorio e antiossidante di HDL; alcuni di questi analoghi presentano inoltre la proprietà, fondamentale dal punto di vista pratico, di essere attivi per via orale e appaiono pertanto molto promettenti nel trattamento dei pazienti con bassi valori plasmatici di HDL-C.
Nel loro insieme, le osservazioni fin qui riportate indicano chiaramente che nei numerosi pazienti con iperlipemia mista (aumento dei trigliceridi, riduzione di HDL-C, aumento delle LDL piccole e dense e aumento globale delle LDL spesso inferiore a quello comunemente osservato nell’iperlipemia familiare) il rischio cardiovascolare è particolarmente elevato (circa il triplo rispetto ai pazienti con semplice ipercolesterolemia) e si riduce solo parzialmente con il trattamento standard mediante statine (38). Ne consegue la necessità non solo di motivare il paziente a seguire corrette abitudini di vita per quanto riguarda l’alimentazione e l’attività fisica e di spingerlo a ottenere e/o mantenere il giusto peso corporeo, ma anche di assicurasi dell’osservanza del trattamento farmacologico. E’ ben noto, infatti, che la percentuale di pazienti che interrompono il trattamento è molto più elevata (15-46% secondo il farmaco in uso) rispetto agli studi clinici controllati e impedisce di riprodurne i benefici nella pratica.
Nei frequenti casi in cui nonostante il rispetto di queste norme il quadro lipidico non viene corretto, la strategia terapeutica va decisa tenendo presente che
- il rischio da dislipidemia è la risultante di alterazioni multiple del metabolismo lipidico e che questo è un sistema integrato che coinvolge tutte le frazioni lipoproteiche;
- la riduzione dei TG e l’aumento di HDL-C riducono il rischio cardiovascolare non meno efficacemente della riduzione di LDL-C;
- l’iperlipemia mista (aumento di LDL, soprattutto piccole e dense, aumento dei trigliceridi e riduzione di HDL) è la dislipidemia più comune e più pericolosa.
Pertanto, nei casi di insufficiente efficacia delle statine, che al momento rimangono comunque i farmaci di prima scelta, l’associazione di un altro farmaco è da preferirsi al raggiungimento di dosi massimali di statina; ciò sia per ridurre il rischio di effetti avversi, sia per agire contemporaneamente su tappe differenti del metabolismo lipidico.
Tra gli altri farmaci attualmente disponibili Fenofibrato presenta tutte le caratteristiche che lo rendono adatto alla associazione per la capacità di ridurre i trigliceridi e le LDL (in particolare le particelle piccole e dense) e di aumentare le HDL. Il timore di interazioni dannose dei fibrati con le statine deriva, come già ricordato, da osservazioni condotte sull’associazione con Gemfibrozil, che però differisce da Fenofibrato per le reazioni di biotrasformazione da cui dipendono i rischi di interazione: e infatti questo rischio non ha trovato conferma in recenti studi controllati. Un’altra possibile associazione, priva di inconvenienti di rilievo e utile soprattutto nei soggetti che hanno subìto un infarto del miocardio, è rappresentata dagli acidi grassi ω-3.
L’uso dell’acido nicotinico associato a Laropirant, di prossima introduzione sul mercato europeo, potrà essere consigliato con tranquillità dopo che una sperimentazione adeguatamente prolungata avrà fornito garanzie sulla sicurezza della somministrazione a lungo termine dell’inibitore dei recettori DP1.
BIBLIOGRAFIA
-
Alsheikh-Ali AA, Kuvin JT, Karas RH: Risk of adverse events with fibrates.
Am J Cardiol 2004:94,935 -
Armitage J: The safety of statins in clinical practice.
Lancet. 2007:370,1781 - Badimon JJ, al: Regression of atherosclerotic lesions by high density lipoprotein plasma fraction in the cholesterol-fed rabbit.J Clin Invest 1990:85,1234
-
Baigent C, Keech A, Kearney PM al: Cholesterol Treatment Trialists (CTT) Collaborators: Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90056 participants in 14 randomised trials of statins.
Lancet 2005:366,1267 -
Bansal S, Buring JE, Rifai N al: Fasting compared with nonfasting triglycerides and risk of cardiovascular events in women.
JAMA 2007:298,309 -
Barter P, Caulfield M, Eriksson M al: ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events.
New Engl J Med 2007:357,2109 -
Blanco M, Nombela F, Castellanos M al: Statin treatment withdrawal in ischemic stroke: a controlled randomized stydy.
Neurology 2008:70,1720 -
Boen S, Feldman L, Vassy J & al: Systematic review: comparative effectiveness and safety of oral medications for type 2 diabetes mellitus.
Ann Intern Med 2007:147,286 -
BrownG Expert commentary: niacin safety.
Am J Cardiol 2007:99(Supp 6A), 32C -
Brunzell JD, Davidson M, Furberg CD al: Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation.
Diabetes Care 2008:31,811 -
Canner PL, Berge KG, Weminger NK al: Fifteen year mortality in Coronary Drug Project patients: long-term benefit with niacin.
J Am Coll Cardiol 1986:8,1245 -
Cannon CP, Braunwald E, McCabe CH al:Intensive versus moderate lipid lowering with statins after acute coronary syndromes
N Engl J Med 2004:350,1495 -
Coronary Drug Project: Clofibrate and niacin in coronary heart disease.
JAMA 1975:231,360 -
De Longeril M, Renaud S, Mamelle N al: Mediterranean alpha linoleic acid-rich diet in secondary prevention of coronary heart disease.
Lancet 1994:343,1454 -
Ford ES, Capewell S: Coronary heart disease mortality among young adults in the US from 1980 through 2002: concealed levelling of mortality rates.
J Am Coll Cardiol 2007:50,2128 -
Freiberg JJ, Tybjaerg-Hansen A,Jensen JS al: Nonfasting triglycerides and risk of ischemic stroke in the general population
JAMA. 2008:300,2142 -
Fruchard J-C, Sacks FM, Hermans MP al: The Residual Risk Reduction initiative: a call to action to reduce residual vascular risk in dyslipidemic patients.
Diabetes Vasc Dis Res 2008:5,319 -
Gaede P, Vedel P, Larsen N & al: Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes.
N Engl J Med 2003:248,383 -
Gaede P, Lund-Andersen H, Parvin HH al: Effect of multifactorial intervention on mortality in type 2 diabetes.
N Engl J Med 2008:358,580 -
Gaist D, Rodriguez IA, Huerta C al: Lipid-lowering drugs and the risk of myopathy: a population-basedfollow-up study.
Epidemiology 2003:12,565 -
Gertz K, Laufs U, Lindauer U al: Withdrawal of statin treatment abrogates stroke protection in mice.
Stroke 2003:34,551 -
Ginsberg HN: Niacin in the metabolic syndrome: more risk than benefit?
Nat Clin Pract Endocrinol Metab 2006:2,300 -
Ginsberg HN, Bonds D, Lovato LC al: ACCORD Study Group. Evolution of the lipid trial protocol of the Action to Control Cardiovascular Risk in Diabetes (ACCORD) trial.
Am J Cardiol 2007:99(Suppl 12A),56i. -
GISSI-HF Investigators: Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (The GISSI-HF trial): a randomised, double blind, placebo-controlled study.
Lancet. 2008:372,1223 -
Goldberg RB: Impact of thiazolidinediones on serum lipoprotein levels.
Curr Atheroscler Rep 2006:8,397 -
Gross B, Staels B: PPAR agonists: multimodal drugs for the treatment of type-2 diabetes
Best Pract Res Clin Endocrinol Metab 2007:21,687 -
Grundy SM, Vega GL, McGovern ME al: Efficacy, safety, and tolerability of once-daily niacin for the treatment of dyslipidemia associated with type 2 diabetes: results of the Assessment oìf Diabetes Control and Evaluation of the Efficacy of Niaspan Trial.
Arch Intern Med 2002:162,1568 -
Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico.Dietary supplementation with n-3 polyunsaturated fatty acid and vitamin E after myocardial infarction: results of the GISSI-Prevenzione Trial.
Lancet 1999:354,447 -
Guyton GR, Bays HA: Safety consideration with niacin therapy.
M j Cardiol 2007:99 (Suppl 6A):22C -
Harris WS, Connor WE, Alam N al: Reduction of postprandial triglycerides in humans by dietary n-3 fatty acids.
J Lipid Res 1988:29,1453 -
Hernandez M, Whrigt SD, Cai TQ: Critical role of cholesterol ester transfer protein in nicotinic acid-mediated HDL elevation in mice.
Biochem Biophys Res Commun 2007:355,1075 -
Jones PH, Davidson MH: Reporting rate of rabdomyolysis with fenofibrate + statin versus gemfibrozil + statins.
Am J Cariol 2005:95,120 -
Jones PH, Davidson MH, Kashyap ML al: Efficacy and safety of ABT 335 (fenofibric acid) in combination with rosuvastatin in patients with mixed dyslipidemia: fase 3 study.
Atherosclerosis 2009:204,208 -
Kathiresan S, Otvos JD, Sullivan M al: Increased small low-density lipoprotein particle number. A prominent feature of the metabolic syndrome in the Framingham Heart Study.
Circulation 2006:113,20 -
Kearney PM, Blackwell PM, Collins R al, Cholesterol Treatment Trialists (CTT) Collaborators: Efficacy of cholesterol-lowering therapy in 18.686 people with diabetes in 14 randomised trials of statins: a meta-analysis.
Lancet 2008:371,117 -
KeechA, Simes RJ, Bartyer P al:The FIELD Study Investigators. Effects of long-term fenofibtate therapy on cardiovascular events in 9.795 people with type 2 diabetes mellitus (the FIELD Study): randomised controlled trial
Lancet 2005:366,1849 -
Knopp RH: Drug treatment of lipid disorders.
N Engl J Med 1999:341,498 -
Knopp RH, Paramsothy P, Atkinson B al: Comprehensive lipid management versus aggressive low-density lipoprotein lowering to reduce cardiovascular risk.
Am J Cardiol 2008:101(Suppl),48B -
Kris-Etherton PM, Harris WS, Appel LI: American Heart Association. Nutrition Committee. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease.
Circulation 2002:196,2747 -
Lai E, De Lepeleire I, Crumley TM al: Suppression of niacin-induced vasodilation with an antagonist to prostaglandin D2 receptor subtype 1.
Clin Pharmacol Ther 2007:81,849 -
LaRosa JC, Grundy SM, Waters DD al: Treating to New Targets(TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease.
J Med 2005:352,1425 -
Maccubin D, Sirah W, Betteridge A: Lipid-altering efficacy and tolerability profile of extended release niacin/laropiprant in patients with primary hypercholesterolemia or mixed hyperlipidemia.
Eur Heart J 2007:28 (abstract suppl):108, Abstract P715b -
Marchioli R, Barzi F, Bobma E al: GISSI-Prevenzione Investigators. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico. (GISSI)-Prevenzione.
Circulation 2002:105,1897 -
McKenney M, Jones PH, Bays HE al: Comparative effects on lipid levels of combination therapy on lipid levelsof combination therapy with a statin and extended-release niacin or ezetimibe versus a statin alone (the COMPELL Study).
Atherosclerosis 2007:192,432 -
McCormack PL, Keating GM: Prolonged release nicotinic acid. A review of its use in the treatment of dyslipidemia.
Drugs 2005:65,2719 -
Montori VM, Farmer A, Wollan PC al: Fish oil supplementation in type 2 diabetes: a quantitative systemic review,
Diabetes Care 2000:23,1407 -
Nicholls SJ, Tuzcu EM, Sipahi I al: Statins, high-density lipoprotein cholesterol, and regression of coronary atherosclerosis.
JAMA 2007:297,499 -
Nissen SE, Tsumoda T, Tuzcu EM al; Effect of recombinant Apo A-1 Milano on coronary atherosclerosis in patients with acute coronary syndromes: a randomized controlled trial.
JAMA 2003:2902292 -
O’Flaherty M, Ford E, Allender S al: Coronary heart disease trends in England and Wales from 1984 to 2004: concealed levelling of mortality rates among young adults.
Heart 2008:94,178 -
Parikh P, McDaniel MC, Ashen MD al: Diets and cardiovascular disease: an evidence-based assessment.
J Am Coll Cardiol 2005:45,1379 -
Peto R, Emberson J, Landray M al: Analyses of cancer data from three ezetimibe trials.
N Engl J Med 2008:359,1367 -
Prueksaritanont T, Tang C, Qiu Y al: Effects of fibrates on metabolism of statins in human hepatocytes.
Drug Metab Dispos 2002:30,1280 -
Puccetti L, Pasqui AL, Pastorelli M al: Platelet hyperactivity after statin treatment discontinuation.
Thrombos Haemost 2003:90,476 -
Rosenson RS: Current overview of statin-induced myopathy.
Am J Med 2004:116,406 -
Rossebø AB, Pedersen TR, Boman K al: Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis.
N Engl J Med 2008:359,1357 -
Sacks FM, Katan M: Randomized clinical trial on the effects of dietary fat and carbohydrate on plasma lipoprotein and cardiovascular disease.
Am J Med 2002:113(Suppl 9B),13S -
Saleem S, Zhuang H, de Brum-Fernandez A al: PGD2, DP1 receptor protects the brain from ischemia-reperfusion injury.
Eur J Neurosci 2007:26,73 -
Sethi S, Ziouzenkova O, Ni H al: Oxidized omega-3 fatty acids in fish oil inhibit leukocyte-endothelial interaction through activation of PPAR alpha.
Blood 2002:100,1340 -
Staels S, Fruchart JC: Therapeutic roles of peroxisome proliferator-activated receptor agonists.
Diabetes 2005:54,2460 -
Wagstaff LR, Mitton MW, Arvik BM, Doraiswamy PM: Statin-associated memory loss: analysis of 60 case reports and review of the literature.
Pharmacotherapy 2003:23,871 -
Yusuf S, Hawken S, Ounpuu S al: INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (The INTERHEART Study): case-control study.
Lancet 2004:364,937











.png)





